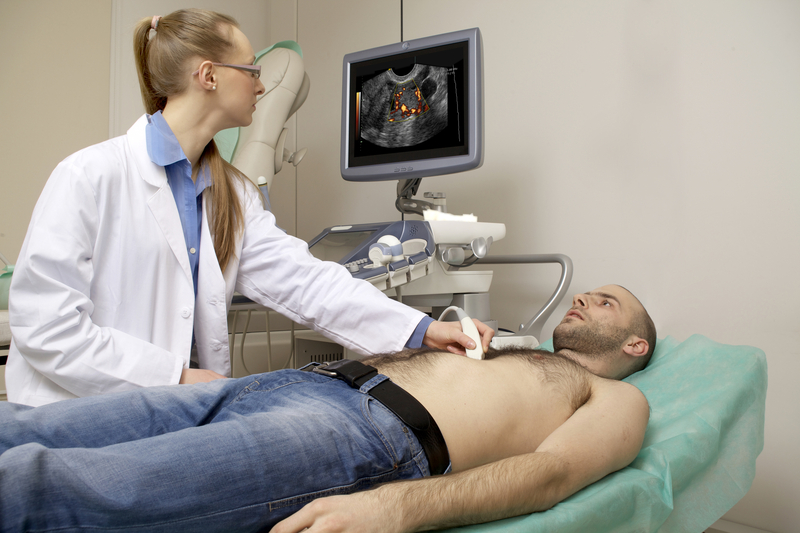
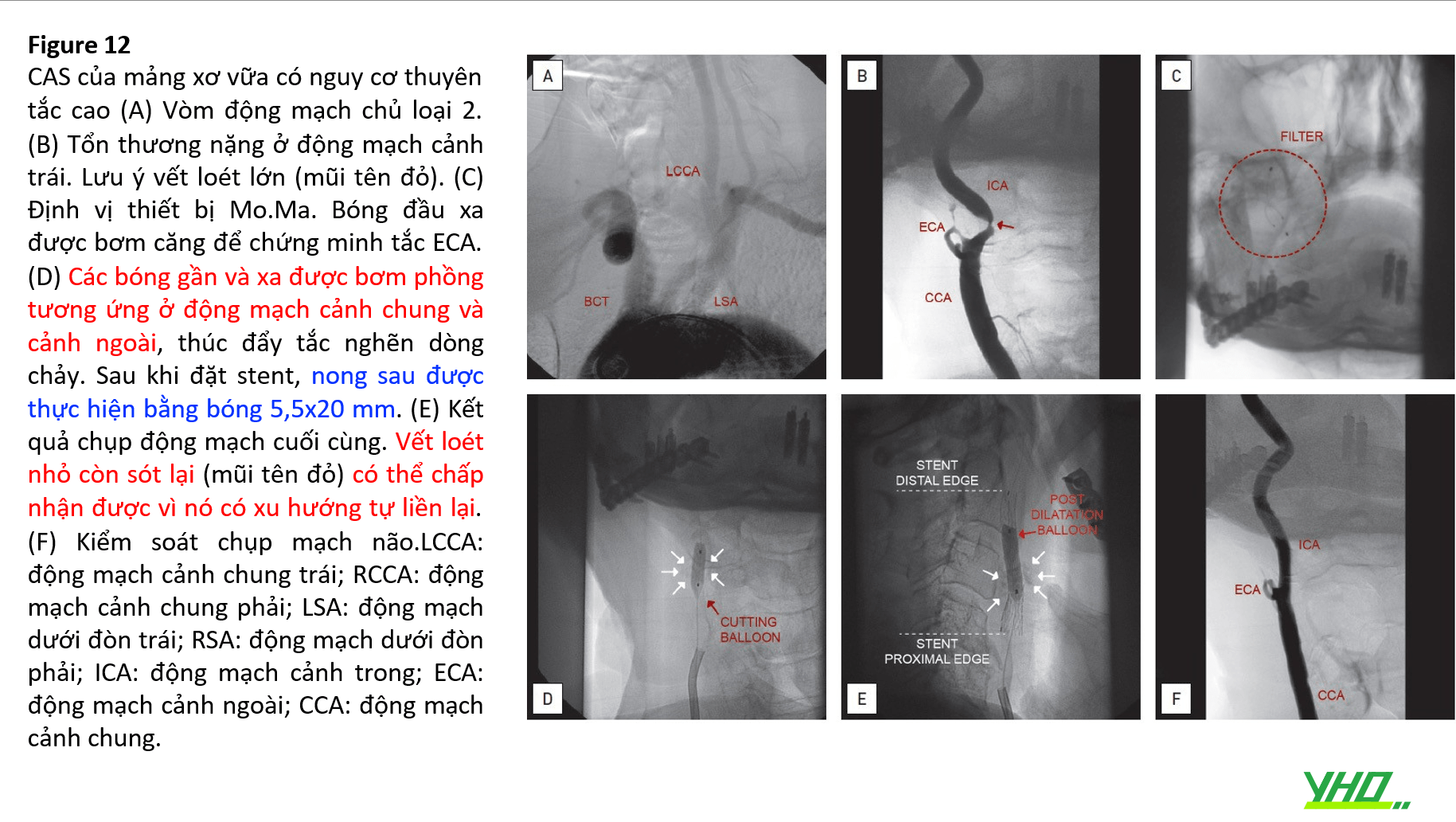
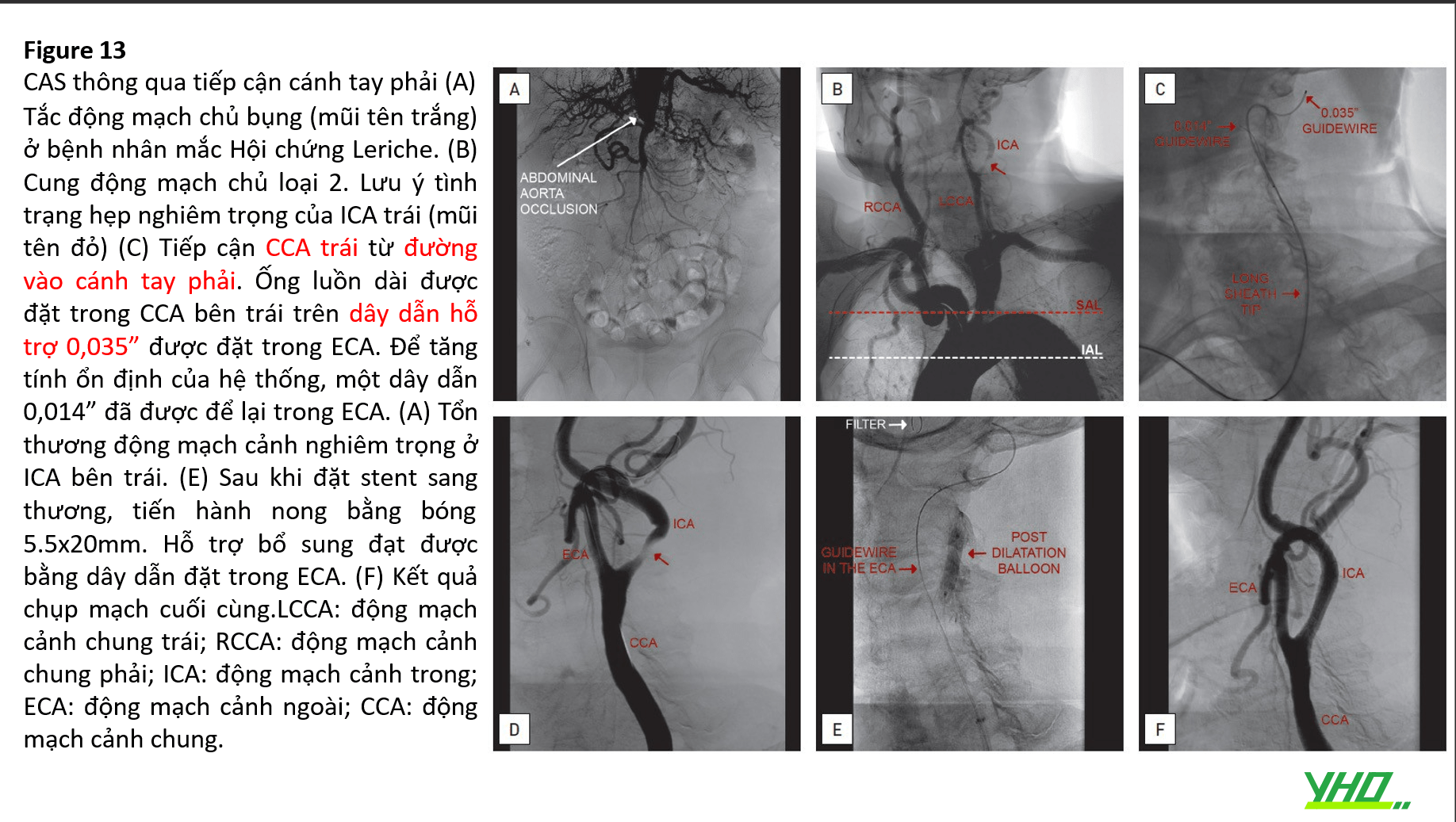
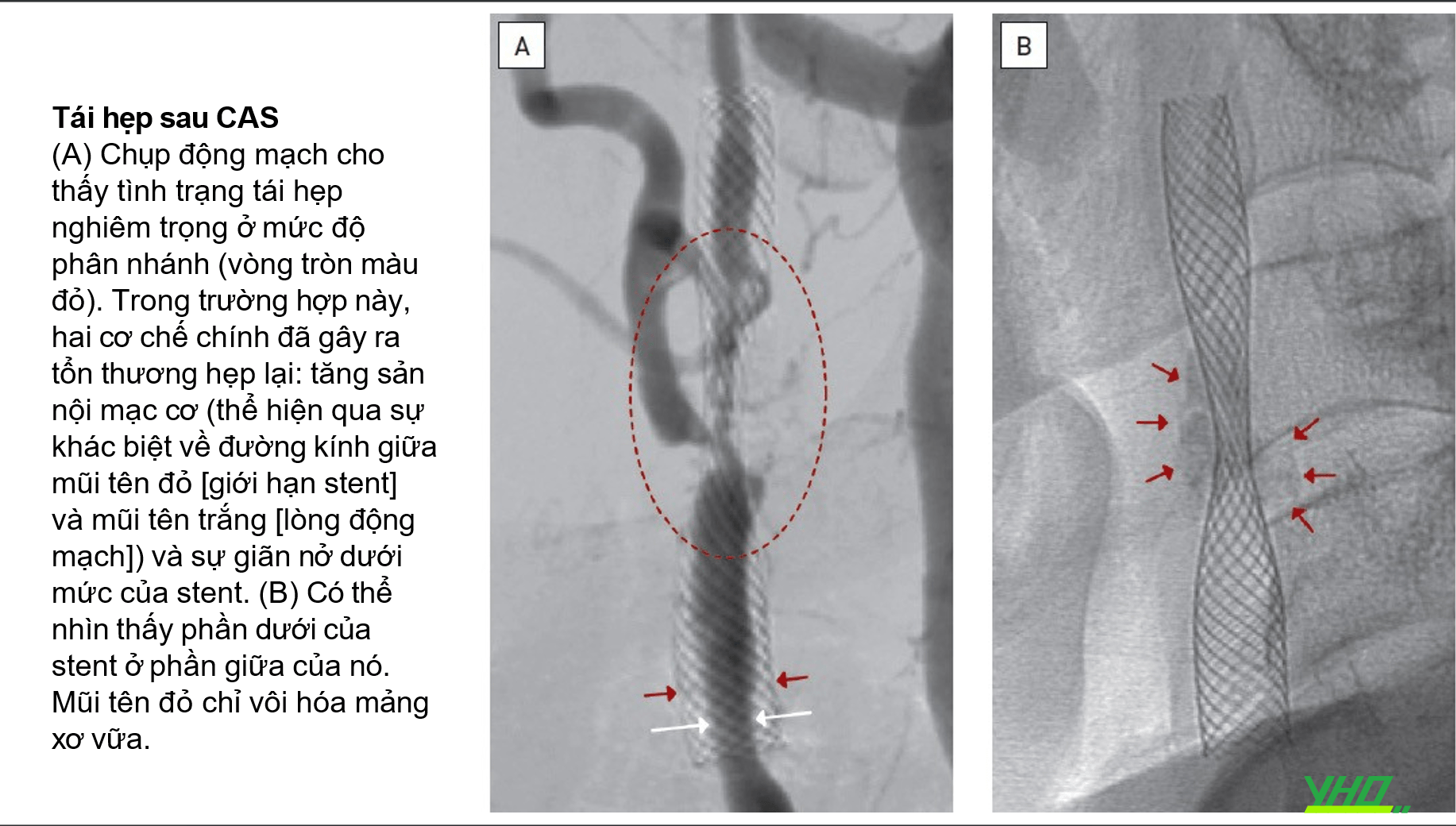
Stent Động Mạch Cảnh

Mục lục
1.Các chỉ định và chống chỉ định hiện tại đối với CAS và tổng quan về dữ liệu lâm sàng
2.Các cân nhắc về kỹ thuật cho 1 thủ thuật CAS an toàn
3.Đánh giá trước thủ thuật
4.Dụng cụ bảo vệ não
5.Stent động mạch cảnh tự bung
6.Các bước tiến hành thủ thuật
Đại cương
Phòng ngừa đột quỵ là ưu tiên chính của sức khỏe cộng đồng
Phẫu thuật cắt bỏ nội mạc động mạch cảnh (CEA), đã có từ hơn 50 năm trước và là phương pháp điều trị tiêu chuẩn cho chứng hẹp động mạch cảnh nghiêm trọng ở bệnh nhân có triệu chứng và không có triệu chứng.
Đặt stent động mạch cảnh (CAS) là một phương pháp điều trị nội mạch mới và hiệu quả, tránh được đau đớn và các biến chứng đi kèm liên quan đến phẫu thuật .
Các thử nghiệm lâm sàng vẫn chưa chỉ ra được bằng chứng rõ ràng về tính ưu việt của một trong hai phương pháp điều trị đối với những bệnh nhân có “nguy cơ phẫu thuật tiêu chuẩn” và đã bị chỉ trích về thiết kế nghiên cứu, tiêu chí lựa chọn bệnh nhân cũng như quá trình đào tạo và chứng nhận tay nghề của bác sĩ tham gia nghiên cứu rất đa dạng.
Vẫn cần bằng chứng chắc chắn trong việc quản lý CAS: lĩnh vực can thiệp này có những thay đổi liên tục trong những năm gần đây tạo ra tình huống thực hành lâm sàng có xu hướng tuân theo các phát triển kỹ thuật dựa trên kinh nghiệm của các bác sĩ giỏi mà chưa có các thử nghiệm ngẫu nhiên được thiết kế để kiểm chứng.
Do đó, CAS chỉ có thể là một phương pháp thay thế cho phẫu thuật nếu các biến chứng quanh thủ thuật bằng hoặc ít hơn các biến chứng liên quan CEA. Từ quan điểm này, việc đánh giá các rủi ro của kỹ thuật CAS trước thủ thuật, sử dụng các thiết bị bảo vệ não, lựa chọn stent và quản lý các biến chứng CAS đều là những điểm mấu chốt để quản lý một quy trình CAS an toàn.
I A. Chỉ định và chống chỉ định hiện nay
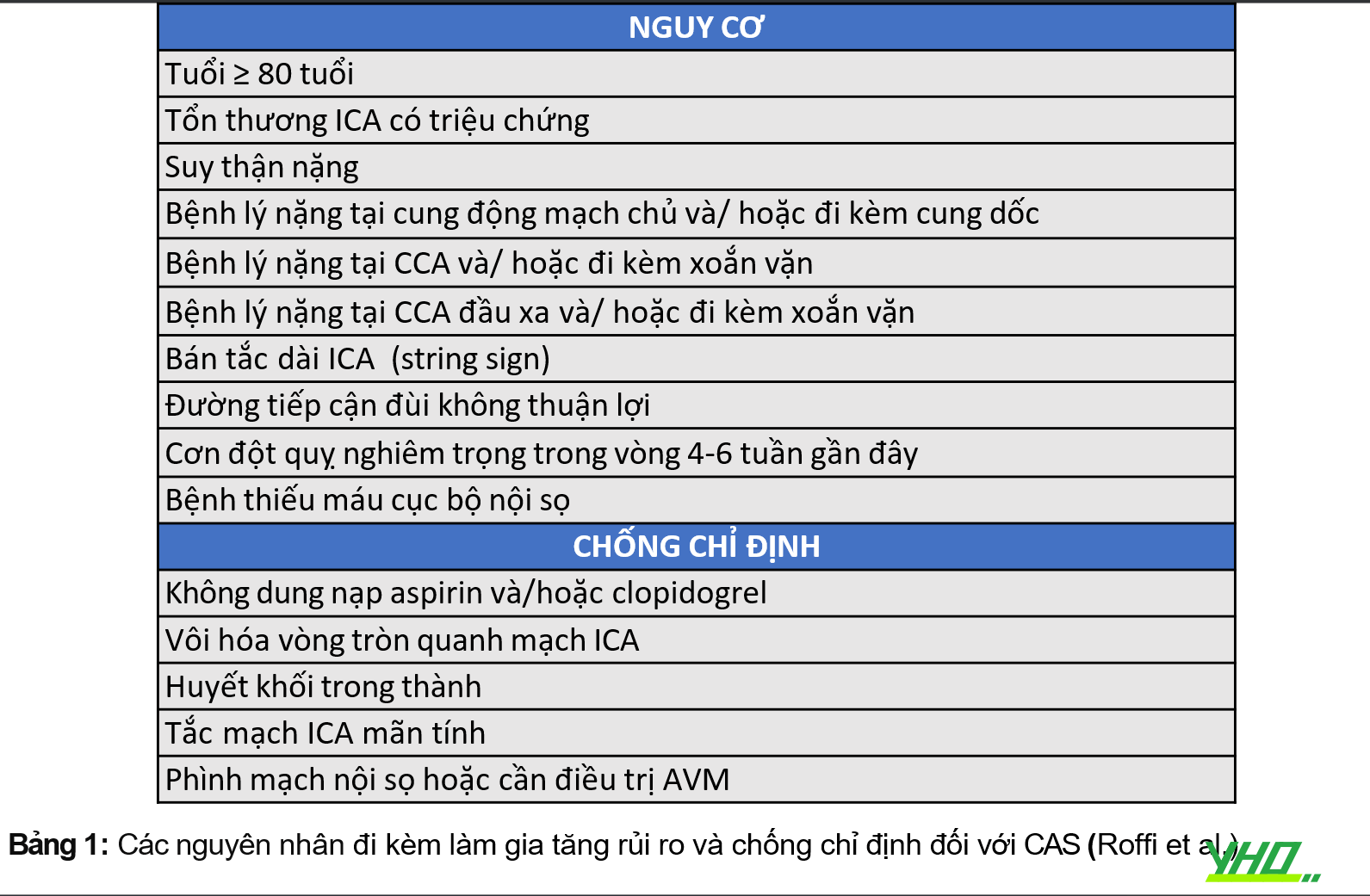
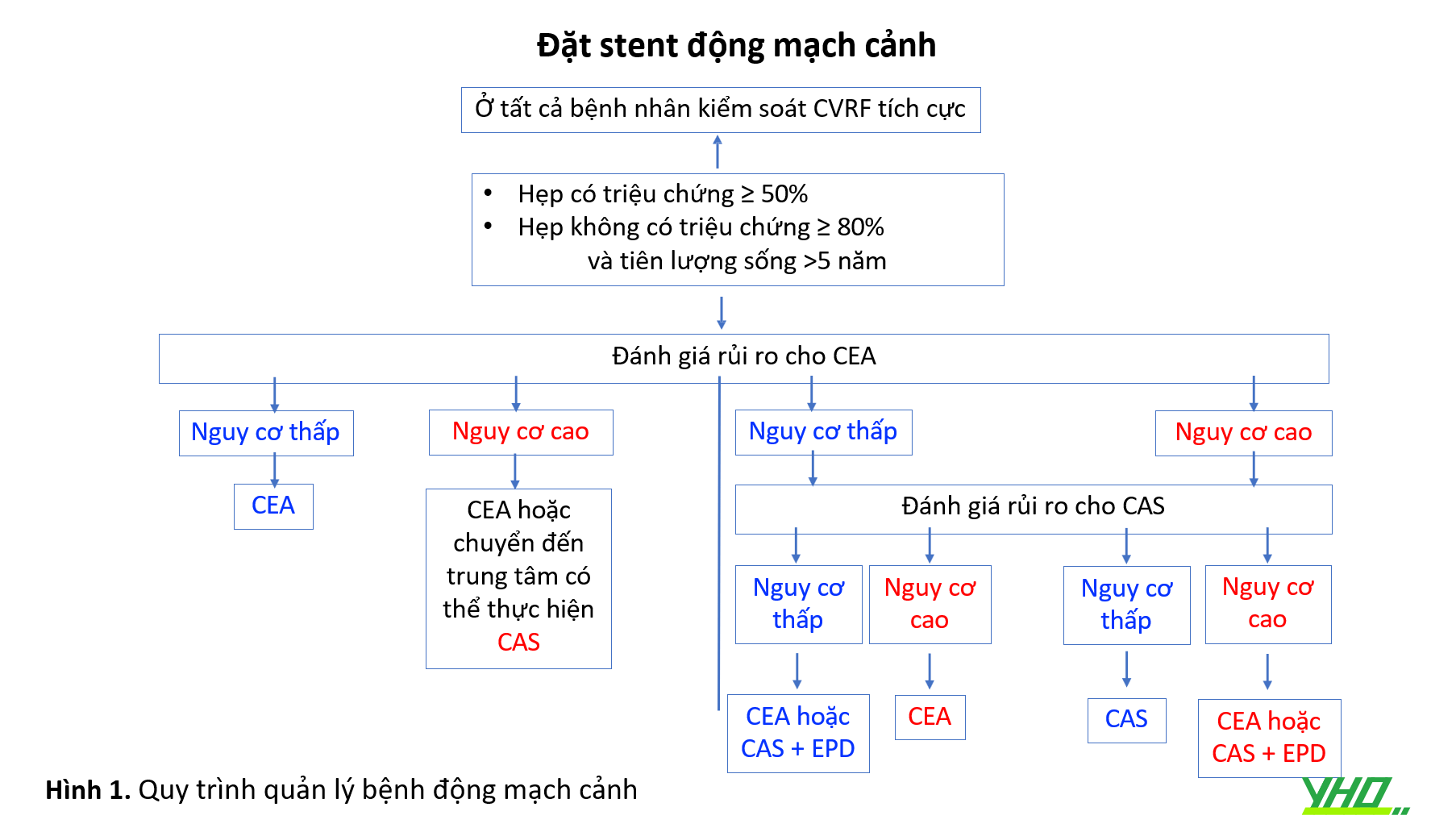
Các điều kiện liên quan đến tăng nguy cơ đặt stent động mạch cảnh (CAS) được liệt kê trong Bảng 1. Theo nguyên tắc chung, kết quả của CAS chủ yếu bị ảnh hưởng bởi giải phẫu của bệnh nhân 1. Giải phẫu thuận lợi dựa trên đánh giá cung động mạch chủ và các mạch máu trên động mạch chủ tăng khả năng thành công của thủ thuật. Ngược lại, kết quả của phẫu thuật chủ yếu bị ảnh hưởng bởi các bệnh đi kèm của bệnh nhân. Do đó, sự lựa chọn giữa CEA và CAS phải dựa trên chuyên môn của từng trung tâm, các nguy cơ phẫu thuật và bệnh lí đi kèm của bệnh nhân (Hình 1). Để lựa chọn bệnh nhân thích hợp cho CAS, điều quan trọng là phải biết các điều kiện làm tăng nguy cơ của thủ thuật.
I B. Tổng quan dữ liệu lâm sàng
CÁC THỬ NGHIỆM LÂM SÀNG NGẪU NHIÊN CỦA CEA VS. CAS
Bảy thử nghiệm lâm sàng lớn (với hơn 300 BN được chọn ngẫu nhiên dùng CEA hoặc CAS) đã được công bố.
1.CAVATAS ( Nghiên cứu tạo hình động mạch cảnh và động mạch đốt sống) 3,
2.SAPPHIRE (Đặt stent và nong mạch có sử dụng Thiết bị bảo vệ não ở bệnh nhân có nguy cơ cao phải cắt bỏ nội mạc động mạch cảnh) 2 bao gồm các bệnh nhân có triệu chứng và không có triệu chứng có nguy cơ phẫu thuật cao.
3.SPACE (Nong động mạch cảnh qua da có stent bảo vệ so với phẫu thuật cắt bỏ nội mạc động mạch) 4,
4.EVA-3S (Cắt mạch nội mạc so với tạo hình mạch máu ở bệnh nhân hẹp động mạch cảnh nặng có triệu chứng) 5,
5.ICSS (Nghiên cứu đa quốc gia về đặt stent mạch cảnh) chỉ tuyển chọn những bệnh nhân có triệu chứng6.
6.CREST (Phẫu thuật nội soi tái thông động mạch cảnh vs. Đặt stent) bao gồm những bệnh nhân có triệu chứng và không có triệu chứng với nguy cơ phẫu thuật thấp hoặc trung bình 7.
7.ACT I (Nghiên cứu về động mạch cảnh không triệu chứng) 8 đã được báo cáo gần đây, so sánh CEA và CAS ở những bệnh nhân không có triệu chứng và không có nguy cơ cao bị biến chứng phẫu thuật.
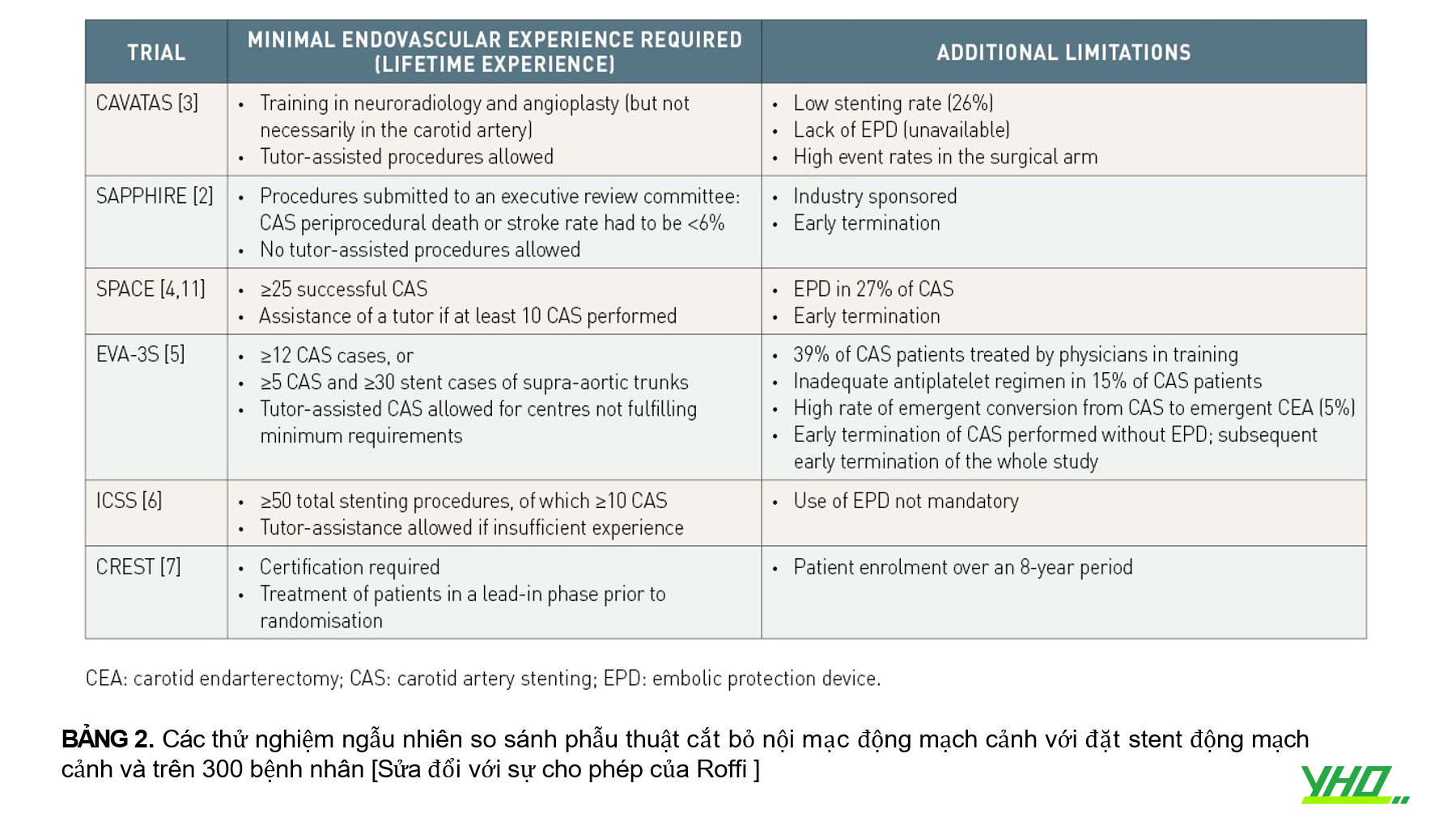
Một số nghiên cứu vẫn gặp một số hạn chế, như được mô tả trong Bảng 2
1. Nghiên cứu CAVATAS
CAVATAS: Thực hiện vào cuối những năm 1990 và công bố năm 2001,
Lựa chọn ngẫu nhiên 504 bệnh nhân có triệu chứng với nguy cơ phẫu thuật từ thấp đến trung bình đối với CEA hoặc can thiệp mạch cảnh 3.
Kết quả cho thấy tỷ lệ tử vong hoặc đột quỵ sau 30 ngày là 10,0% ở nhóm can thiệp nội mạch và 9,9% ở nhóm phẫu thuật. Sau 8 năm, không có sự khác biệt nào được quan sát ở liệt nửa người cùng bên do đột quỵ hoặc TIA, hoặc bất kỳ đột quỵ nào giữa hai nhánh 9.
Các bác sĩ phẫu thuật chỉ trích nghiên cứu này do tỷ lệ biến cố cao ở nhánh phẫu thuật nếu so sánh với các thử nghiệm NASCET và ECST.
Cộng đồng can thiệp chỉ trích vì tỷ lệ đặt stent thấp (26%) và thiếu sử dụng thiết bị bảo vệ chống tắc mạch (EPD). Trên thực tế, EPD không có sẵn vào thời điểm đó. Stent chỉ có sẵn từ năm 1994 và việc sử dụng chúng tăng lên vào cuối nghiên cứu.
Một khía cạnh tích cực của thử nghiệm này là đánh giá thần kinh độc lập cho đến thời điểm đó đã không được thực hiện một cách nhất quán trong các nghiên cứu trước đây.
CAVATAS chọn ngẫu nhiên 334 bệnh nhân có nguy cơ phẫu thuật cao đối với CAS khi sử dụng EPD hoặc CEA một cách có hệ thống.
Thử nghiệm bao gồm bệnh nhân không có triệu chứng (71%) và có triệu chứng (29%). Tiêu chí chính bao gồm tổng hợp các nguy cơ tử vong, đột quỵ, nhồi máu cơ tim trong vòng 30 ngày sau can thiệp, hoặc tử vong hoặc liệt nửa người cùng bên do đột quỵ trong khoảng thời gian từ 31 ngày đến 1 năm
CAS được ủng hộ mạnh mẽ, TC chính xảy ra 12,2% ở nhóm CAS và 20,1% ở nhóm CEA (p=0,053). Bệnh nhân trải qua CAS ít bị nhồi máu cơ tim hơn đáng kể sau 30 ngày so với những bệnh nhân được chọn ngẫu nhiên cho CEA (1,9% so với 6,6%, p=0,04).
Sau 3 năm theo dõi, CAS và CEA có hiệu quả như nhau trong việc ngăn ngừa đột quỵ10 .
2. Nghiên cứu SAPPHIRE
Thử nghiệm SAPPHIRE vẫn là độc nhất ở một số khía cạnh:
•tiêu chí bắt buộc đối với kinh nghiệm can thiệp để tham gia nghiên cứu (kinh nghiệm trung bình của các bác sĩ can thiệp với thủ thuật là 64 trường hợp, phạm vi từ 20 đến 700);
•không chấp nhận thực hiện CAS trong điều kiện tutor;
•bắt buộc sử dụng EPD và
•phát hiện nhồi máu cơ tim trong thủ thuật bằng phương pháp đo men tim có hệ thống.
3. nghiên cứu SPACE
Nghiên cứu đa trung tâm nhằm mục đích kiểm tra tính không thua kém của CAS so với CEA ở những bệnh nhân có triệu chứng hẹp vừa đến nặng.
•Nghiên cứu đã dừng lại do không thể đưa 1.200 bệnh nhân vào nghiên cứu và không đủ kinh phí để tăng số lượng bệnh nhân lên 2.500 để đạt giá trị thống kê chứng minh tính không thua kém của CAS.
•Nghiên cứu không tìm thấy sự khác biệt về tỷ lệ liệt nửa người cùng bên do đột quỵ hoặc tử vong sau 30 ngày giữa các bệnh nhân được phân bổ cho CAS hoặc CEA, với tỷ lệ biến cố lần lượt là 6,8% và 6,3%.
•Nghiên cứu không chứng minh được tính không thua kém của CAS so với CEA mặc dù sự khác biệt giữa hai phương pháp điều trị là rất nhỏ (chỉ có 4 biến cố trên gần 600 bệnh nhân mỗi nhóm).
•Các thiết bị bảo vệ tắc mạch được sử dụng ở một số ít bệnh nhân CAS (27%).
•Sau 2 năm, kết quả của hai nhóm tương đương nhau 11
4. Thử nghiệm EVA-3S
Thử nghiệm EVA-3S của Pháp nhằm mục đích kiểm tra tính không thua kém của CAS so với CEA ở những bệnh nhân có triệu chứng, hẹp động mạch cảnh từ 60% trở lên.
•Nghiên cứu với 527 bệnh nhân đã bị dừng sớm vì tỷ lệ biến cố tăng đáng kể trong số những người được chỉ định điều trị CAS (tử vong hoặc đột quỵ 9,6% ở nhóm CAS và 3,9% ở nhóm CEA).
•Sau 6 tháng, tỷ lệ đột quỵ hoặc tử vong là 11,7% ở nhóm CAS và 6,1% ở nhóm CEA (p=0,02). Nghiên cứu đã bị chỉ trích nặng nề vì các yêu cầu tối thiểu về kinh nghiệm điều trị can thiệp (Bảng 2).
•Về khía cạnh điều trị can thiệp, 39% bệnh nhân được điều trị bởi bác sĩ đã qua đào tạo. Sau 4 năm theo dõi, tỷ lệ tử vong hoặc đột quỵ vẫn nghiêng về CEA với thời gian theo dõi 30 ngày. Tuy nhiên, sau 30 ngày, không có sự khác biệt về kết quả bất lợi giữa CAS và CEA được quan sát 12 .
5. Thử nghiệm ICSS
•Chọn ngẫu nhiên 1.710 bệnh nhân có triệu chứng hẹp động mạch cảnh hơn 50% trong số 50 trung tâm ở Châu Âu, Úc, New Zealand và Canada từ tháng 5 năm 2001 đến tháng 10 năm 2008 và kết thúc vào năm 2011 6 13 .
•Tiêu chí đánh giá chính được xác định trước là tỷ lệ đột quỵ gây tử vong hoặc tàn tật trong 3 năm ở bất kỳ vùng lãnh thổ nào sau khi phân nhóm ngẫu nhiên.
•Các tiêu chí phụ là đột quỵ, đột quỵ hoặc tử vong, đột quỵ hoặc tử vong do thủ thuật, đột quỵ hoặc tử vong do tàn tật và tử vong do mọi nguyên nhân. Bệnh nhân được theo dõi trung bình 4,2 năm sau khi phân nhóm ngẫu nhiên.
•Tiêu chí đánh giá chính được ghi nhận ở 52 trong số 853 bệnh nhân trong nhóm CAS (nguy cơ tích lũy trong 5 năm là 6,4%) và ở 49 trong số 857 bệnh nhân trong nhóm cắt nội mạc (nguy cơ tích lũy trong 5 năm là 6,5%), cho thấy rằng CAS là hiệu quả như CEA trong việc ngăn ngừa nguy cơ đột quỵ gây tử vong hoặc tàn tật ở bệnh nhân hẹp động mạch cảnh có triệu chứng. Về các tiêu chí phụ, đặt stent động mạch cảnh có liên quan đến nguy cơ đột quỵ lâu dài và liên quan đến thủ thuật cao hơn, với nguy cơ tích lũy 5 năm là 15,2% so với 9,4% ở nhóm cắt bỏ nội mạc (HR 1,171, KTC 95% 1,28 -2,30) do mất chức năng và chất lượng cuộc sống không khác nhau giữa các nhóm.
•Trong giai đoạn sau thủ thuật, sự khác biệt chính giữa hai nhóm về nguy cơ đột quỵ chủ yếu là do sự xuất hiện của đột quỵ ở động mạch cảnh đối bên hoặc vùng đốt sống ở nhóm đặt stent. Các tác giả không có lời giải thích kết luận cho phát hiện này.
•Tỷ lệ tử vong do mọi nguyên nhân không khác biệt đáng kể giữa các nhóm. Tỷ lệ rủi ro đối với đột quỵ do thủ thuật hoặc tử vong do thủ thuật, hoặc liệt nửa người cùng bên do đột quỵ trong quá trình theo dõi thấp hơn đối với những bệnh nhân được điều trị tại các trung tâm “lớn hơn” (theo dõi 50 bệnh nhân trở lên trong thử nghiệm, tức là trung bình tối thiểu chỉ 10 bệnh nhân được đưa vào mỗi năm) . Một lần nữa, một số chỉ trích đã được đưa ra liên quan đến kinh nghiệm của các thủ thuật viên trong thử nghiệm ICSS.
•Trong nghiên cứu, ‘ các trung tâm có kinh nghiệm’ được yêu cầu phải có những thủ thuật viên đã thực hiện ít nhất 50 ca đặt stent, trong đó chỉ có 10 ca CAS. ‘ Các trung tâm được giám sát ‘, nơi các thủ thuật viên không đáp ứng các yêu cầu đó, có thể thực hiện các quy trình với sự hướng dẫn từ chuyên gia. Ngoài ra, để củng cố những lời chỉ trích về thiếu kinh nghiệm điều trị trong thử nghiệm này, hai thủ thuật viên từ các trung tâm đặt stent riêng biệt mà các ca họ có xảy ra nhiều biến cố bất lợi (n=11, trong đó năm người bị đột quỵ hoặc tử vong), đã bị yêu cầu ngừng tham gia điều trị cho bệnh nhân trong thử nghiệm và các trung tâm đã bị đình chỉ tham gia, tuy nhiên những bệnh nhân này vẫn đã được đưa vào phân tích thử nghiệm.
•Một phân tích tổng hợp về các thử nghiệm được đề cập ở mô tả trong Hình 2
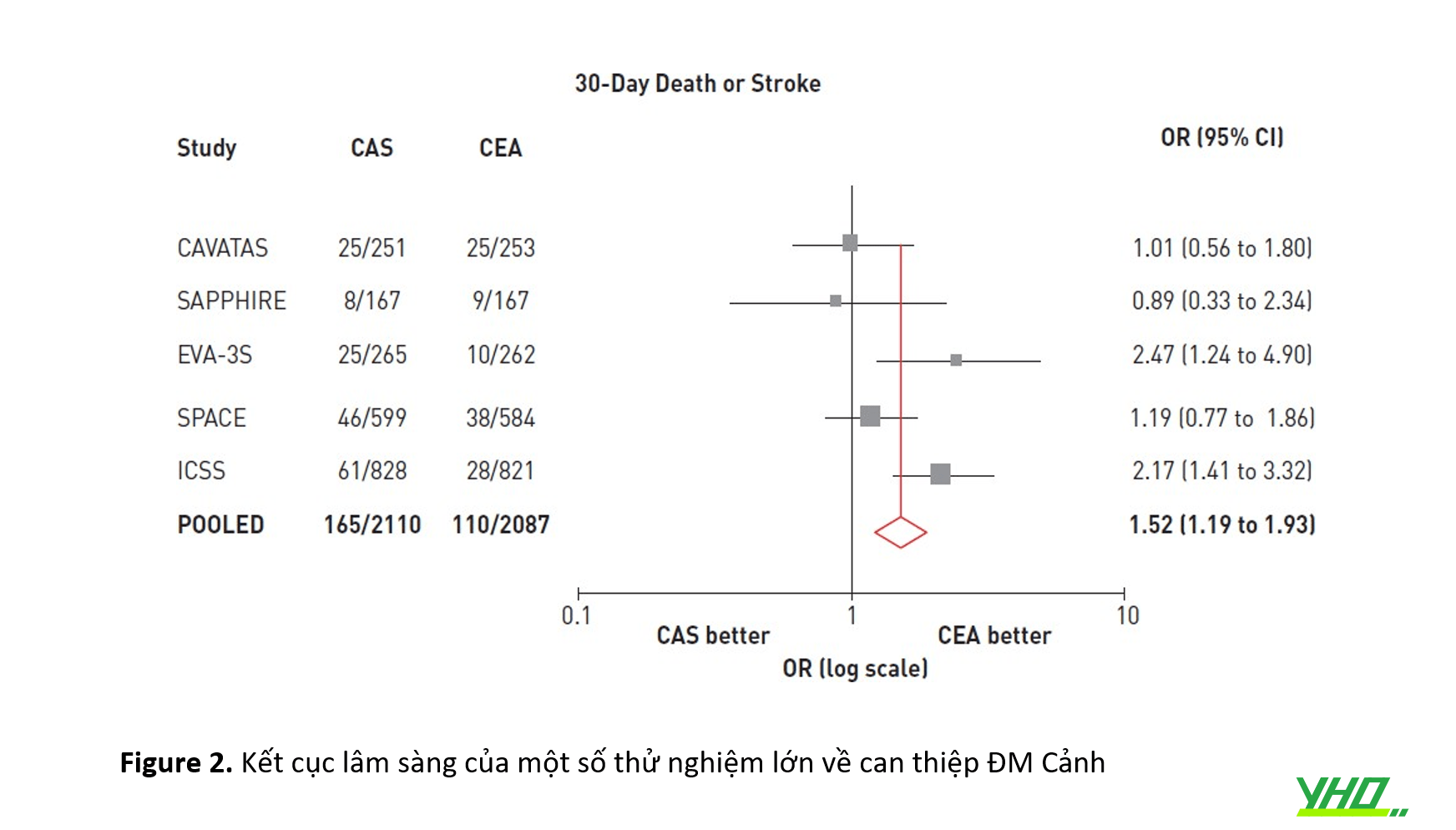
6. Nghiên cứu CREST
•Chọn ngẫu nhiên 2.502 bệnh nhân dùng CEA hoặc CAS + EPD.
•Tiêu chí đánh giá chính bao gồm các biến cố gộp- đột quỵ, nhồi máu cơ tim hoặc tử vong do bất kỳ nguyên nhân nào trong giai đoạn quanh thủ thuật hoặc bất kỳ biểu hiện liệt nửa người cùng bên do đột quỵ trong vòng 4 năm sau khi phân nhóm ngẫu nhiên cho thấy không khác biệt giữa hai nhóm (7,2% ở nhóm CAS và 6,8% ở nhóm CEA).
•Tỷ lệ chu phẫu của từng thành phần trong tiêu chí gộp khác nhau giữa nhóm đặt stent và nhóm cắt nội mạc: đối với tử vong (0,7% so với 0,3%, p=0,18), đối với đột quỵ (4,1% so với 2,3%, p=0,01), và đối với nhồi máu cơ tim (1,1% so với 2,3%, p=0,03).
•Sau giai đoạn này, tỷ lệ đột quỵ cùng bên khi CAS và CEA cũng thấp tương tự (2,0% và 2,4%, p=0,85). Mặc dù tỷ lệ tử vong hoặc đột quỵ quanh thủ thuật ở CAS cao hơn so với CEA, cả ở bệnh nhân có triệu chứng và không có triệu chứng, lần đầu tiên CAS đã thành công trong một thử nghiệm ngẫu nhiên đáp ứng khuyến nghị của Hiệp hội Tim mạch Hoa Kỳ là 6,0% đối với bệnh nhân có triệu chứng và 3,0% đối với bệnh nhân không có triệu chứng. Theo đó, tỷ lệ quan sát được trong nhánh CAS của CREST lần lượt là 6,0% và 2,5%. Kết quả theo dõi 10 năm của CREST gần đây đã được công bố 14 .
•Các nhà nghiên cứu không thấy sự khác biệt đáng kể giữa những bệnh nhân trải qua CAS hoặc CEA về nguy cơ đột quỵ quanh thủ thuật, nhồi máu cơ tim hoặc tử vong và đột quỵ cùng bên sau đó. Tỷ lệ đột quỵ cùng bên sau thủ thuật (điểm cuối dài hạn chính) cũng không khác nhau giữa CAS (6,9%) và CEA (5,6%) (tỷ lệ rủi ro, 0,99; 95% CI, 0,64 đến 1,52).
7. Thử nghiệm ACT I
•Thử nghiệm ACT I đã so sánh CAS với biện pháp bảo vệ tắc mạch và CEA ở những bệnh nhân không có triệu chứng có nguy cơ biến chứng phẫu thuật tiêu chuẩn.
•Thử nghiệm được thiết kế với 1.658 bệnh nhân nhưng đã bị dừng sớm sau khi
1.453 bệnh nhân được phân ngẫu nhiên do quá trình triển khai chậm.
•Tiêu chí đánh giá tổng hợp chính gồm tử vong, đột quỵ hoặc nhồi máu cơ tim trong vòng 30 ngày sau thủ thuật hoặc liệt nửa người cùng bên do đột quỵ trong vòng 1 năm đã được thử nghiệm với biên độ không thua kém là 3 điểm phần trăm.
•Các kết quả gần đây đã được công bố 8 cho thấy CAS không thua kém CEA về các tiêu chí đánh giá tổng hợp chính (tỷ lệ biến cố, tương ứng là 3,8% và 3,4%; p=0,01 đối với tính không thua kém).
•Tỷ lệ đột quỵ hoặc tử vong trong vòng 30 ngày dưới 3% ở cả hai nhóm (2,9% ở nhóm CAS và 1,7% ở nhóm CEA, p=0,33). Tỷ lệ hồi phục liệt nửa người cùng bên do đột quỵ từ 30 ngày đến 5 năm là 97,8% ở nhóm CAS và 97,3% ở nhóm CEA (p=0,51).
•Một điểm cần nhấn mạnh là kinh nghiệm của thủ thuật viên và trung tâm là yếu tố cần thiết trong việc thực hiện cả hai phương pháp điều trị. Các địa điểm nghiên cứu và các bác sĩ đã được lựa chọn theo một quy trình bao gồm đánh giá chứng nhận và đào tạo của Hội đồng Chuyên khoa Y tế Hoa Kỳ, kinh nghiệm của thủ thuật viên trước đó (25 trường hợp CAS hoặc CEA gần đây cho mỗi người).
•Nghiên cứu cũng bao gồm một giai đoạn kiểm tra, trong đó các thủ thuật viên phải chứng minh sự thành thạo với các thiết bị nghiên cứu trong ít nhất hai trường hợp. Các trung tâm tham gia nghiên cứu cũng được kiểm tra nếu có những hoạt động không thuận lợi xảy ra (hai địa điểm tạm thời ngừng đăng ký bệnh nhân).
•Một hạn chế của nghiên cứu là độ tin cậy giảm từ 80% (nếu tất cả 1.658 bệnh nhân theo kế hoạch ban đầu được tuyển dụng) xuống 75% với tổng số 1.453 bệnh nhân tham gia nghiên cứu.
8. Nghiên cứu ASCT-2
•Nghiên cứu ngẫu nhiên đa quốc gia nhằm để so sánh CEA với CAS (1:1) ở bệnh nhân hẹp động mạch cảnh không triệu chứng. ACST-2 hiện đang tuyển dụng bệnh nhân từ khắp nơi trên thế giới và dự định cần ít nhất 5.000 người. Cho đến thời điểm hiện tại, thử nghiệm đã tuyển chọn 2.044 bệnh nhân và 3.600 bệnh nhân được lên kế hoạch vào cuối năm 2019.
•Dữ liệu sẽ được phân tích trên cơ sở điều trị có chủ đích; tiêu chí chính là các rủi ro quanh thủ thuật (NMCT, đột quỵ và tử vong trong tháng đầu tiên) và phòng ngừa đột quỵ lâu dài (lên đến 5 năm trở lên), đặc biệt là đột quỵ gây tàn tật hoặc gây tử vong ở hai nhóm điều trị.
•Các tiêu chí thứ cấp là yếu tố kinh tế như chi phí thủ thuật, chi phí chăm sóc sức khỏe liên quan đến đột quỵ và đánh giá chất lượng cuộc sống. Thủ thuật viên can thiệp đặt stent có thể là bác sĩ X quang, bác sĩ tim mạch, bác sĩ phẫu thuật hoặc bác sĩ được đào tạo chuyên môn về đặt stent động mạch cảnh. Các bác sĩ phải thực hiện quy trình cụ thể (CEA hoặc CAS) 25 lần trở lên để tham gia thử nghiệm. Nói chung, các bác sĩ cần có kinh nghiệm với các chỉ số như nguy cơ đột quỵ và tử vong ≤ 8% đối với bệnh nhân có triệu chứng và ≤ 4% đối với bệnh nhân không có triệu chứng. Kết quả của thử nghiệm này hy vọng sẽ xua tan một số nghi ngờ về việc điều trị bệnh nhân không có triệu chứng.
CÁC THỬ NGHIỆM CAS
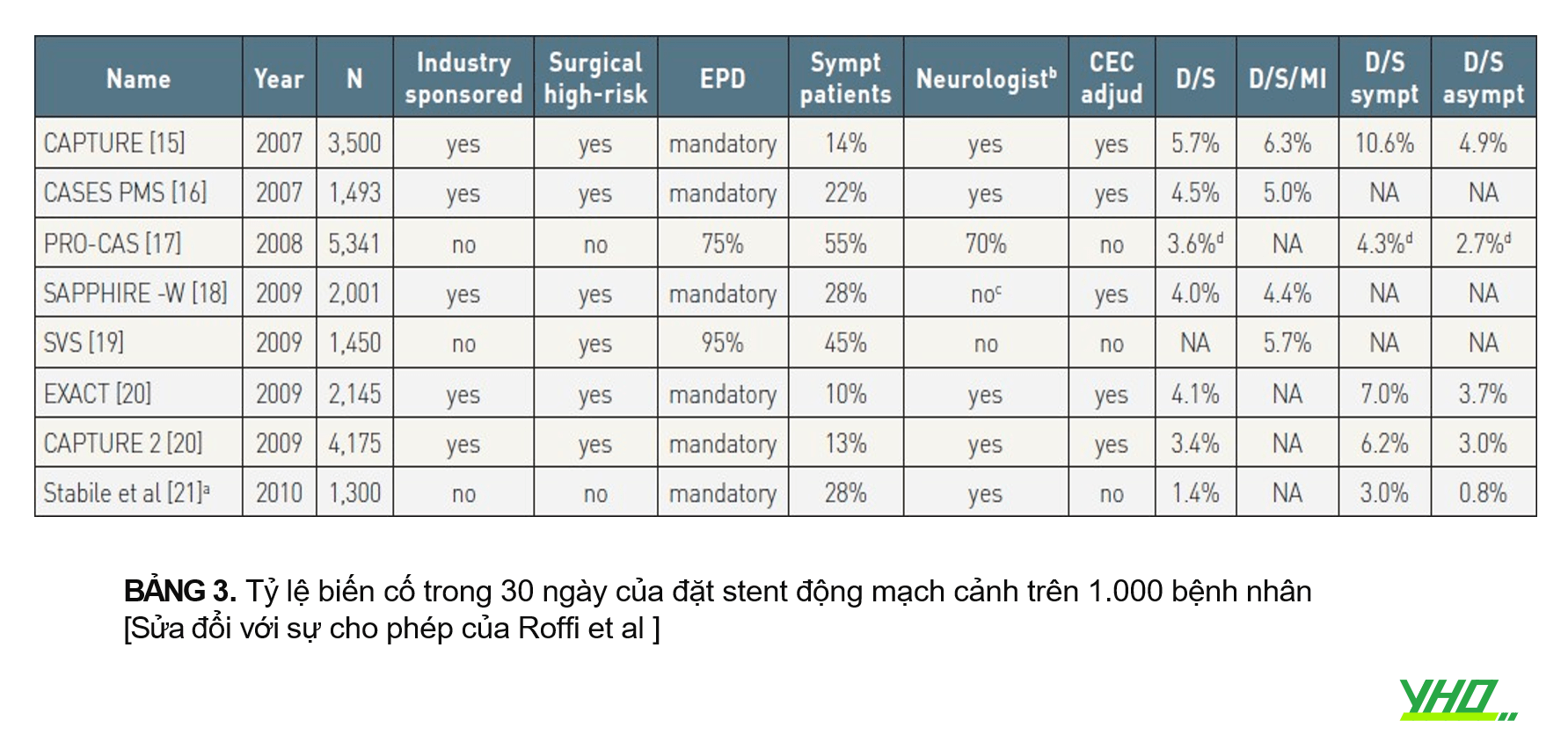
•Kết quả của tám NC đăng ký CAS với hơn 1.000 bệnh nhân đã được công bố trên tổng số 21.405 bệnh nhân. Tất cả bao gồm những bệnh nhân có nguy cơ phẫu thuật cao và phần lớn bệnh nhân không có triệu chứng. Phương pháp tốt của các nghiên cứu được chứng minh bằng tỷ lệ cao của các đánh giá thần kinh bắt buộc trước và sau thủ thuật và đánh giá của ủy ban lâm sàng về các kết quả bất lợi. Việc sử dụng EPD là bắt buộc trong năm cơ quan đăng ký và được sử dụng ở phần lớn bệnh nhân trong hai cơ quan còn lại. Nhìn chung, các nghiên cứu cho thấy kết quả nằm trong phạm vi khuyến nghị hiện tại đối với CEA ngay cả ở những bệnh nhân có nguy cơ phẫu thuật cao và kết quả đã được cải thiện theo thời gian (Bảng 3).
•Khi nào cần can thiệp cho bệnh nhân mắc bệnh động mạch cảnh nặng: Lý do duy nhất
để điều trị hẹp động mạch cảnh là phòng ngừa đột quỵ
•Trong bệnh động mạch cảnh nặng có triệu chứng, các hướng dẫn cập nhật cung cấp các khuyến nghị rõ ràng cho các chiến lược điều trị cá thể
•Ở những tổn thương không có triệu chứng, nguy cơ đột quỵ liên quan đến bất kỳ loại can thiệp dự phòng nào không được vượt quá nguy cơ vốn có trong quá trình xơ vữa động mạch cảnh tự nhiên: 1% -3% mỗi năm
•Nguy cơ thấp đối với bệnh động mạch cảnh không có triệu chứng lâm sàng có thể trở nên cao hơn đáng kể trong một số nhóm cá thể nhỏ (8% đến 14% mỗi năm)
•Đối với CAS, kinh nghiệm của bệnh viện và bác sĩ tương quan với kết quả của bệnh nhân
2. CÁC CÂN NHẮC VỀ KỸ THUẬT CHO 1 THỦ THUẬT CAS AN TOÀN
Quy tắc 3% – 6% về tỷ lệ tử vong do thủ thuật hoặc đột quỵ tương ứng lần lượt với bệnh nhân không có triệu chứng và bệnh nhân có triệu chứng. Tỷ lệ biến chứng cao hơn có thể chấp nhận được đối với CAS (CAS) 15. Ngoài những ranh giới đó, tái thông mạch cảnh có thể không mang lại lợi ích so với điều trị nội khoa. Thiết lập mức độ phức tạp về kỹ thuật của thủ thuật bằng cách đánh giá biểu hiện lâm sàng của bệnh nhân, sau đó là các khía cạnh giải phẫu của mạch máu, cũng như các đặc điểm siêu âm và các hình ảnh chụp tổn thương động mạch cảnh là điều cần thiết để dự đoán các cách thực hiện của thủ thuật viên để đạt được một thủ thuật an toàn. Một số khái niệm quan trọng liên quan đến sự an toàn của thủ tục được thảo luận dưới đây.
1.KHÁI NIỆM TIẾP CẬN ĐIỀU CHỈNH
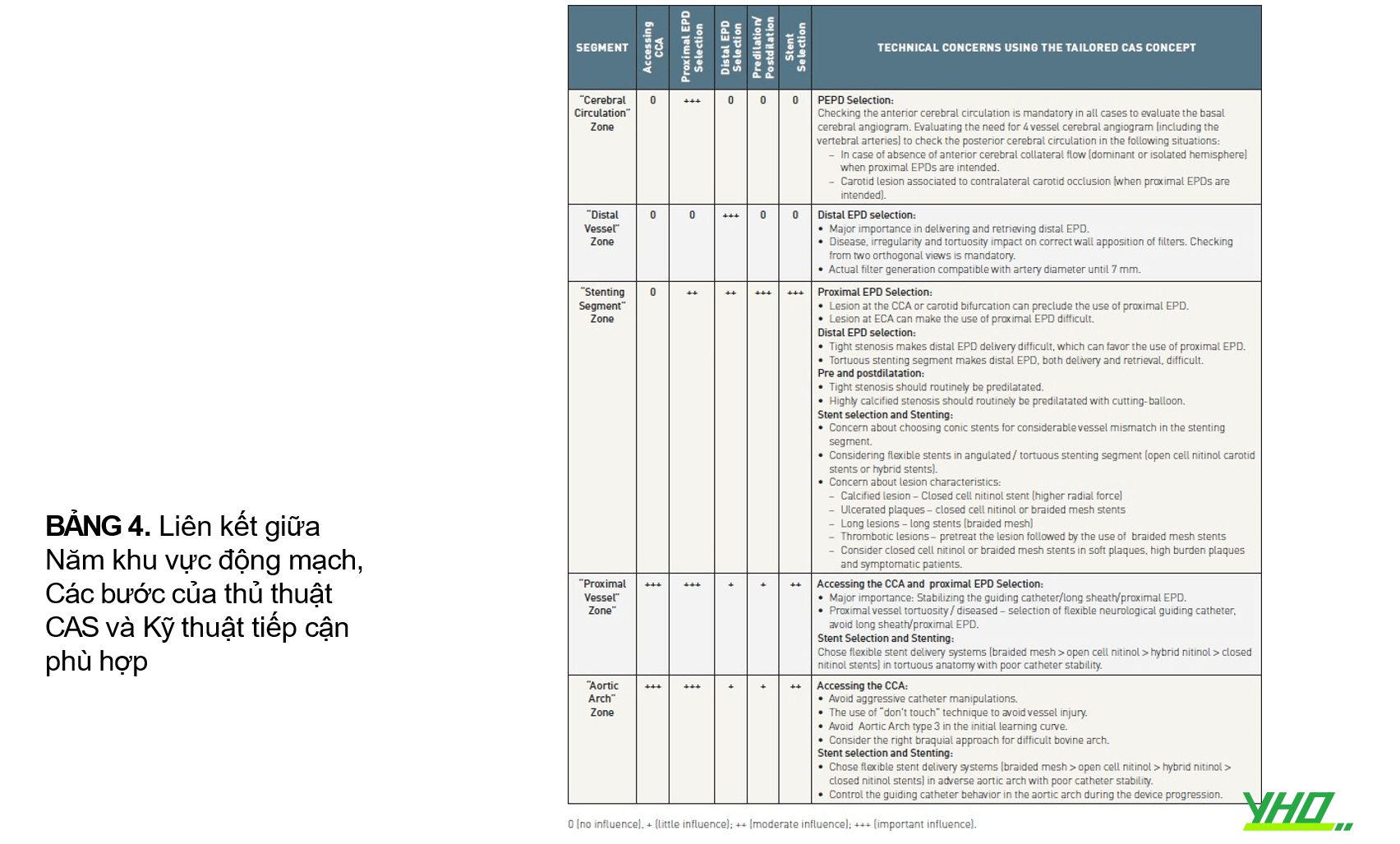
•“Cách tiếp cận phù hợp” với CAS bao gồm lập kế hoạch chiến lược cụ thể cho một bệnh nhân cụ thể. Cách tiếp cận này phụ thuộc vào kiến thức chuyên sâu về tất cả các đặc điểm của các dụng cụ can thiệp (như guiding catheter, guiding sheath, dây dẫn, thiết bị bảo vệ tắc mạch, bóng và stents) để phù hợp nhất với giải phẫu của mạch máu, các tổn thương động mạch cảnh, cũng như biểu hiện lâm sàng của bệnh nhân 16. Kết quả công bố gần đây của “Tailored CASE registry” phân tích việc sử dụng “phương pháp phù hợp” trong 1.523 thủ thuật 17. Tỷ lệ thành công của thủ thuật là 99,6 %. Tỷ lệ đột quỵ và tử vong trong 30 ngày lần lượt là 1,2% (n=14) và 2,7% (n=10) đối với nhóm bệnh nhân không có triệu chứng và có triệu chứng. Dân số có nguy cơ cao nhất, tức là những bệnh nhân có triệu chứng trên 80 tuổi, có tỷ lệ đột quỵ và tử vong trong 30 ngày là 4,5%. Dựa trên những phát hiện này, việc sử dụng “phương pháp phù hợp” của những thủ thuật viên có kinh nghiệm dường như là một công cụ có giá trị để tăng cường độ an toàn của thủ thuật.
2.STENT SCAFFOLDING
•Thuyên tắc mạch xa là biến chứng thần kinh lớn không chỉ trong quá trình phẫu thuật mà còn trong giai đoạn hậu phẫu lên đến 30 ngày 18. Việc sử dụng EPD được nhấn mạnh là để giảm nguy cơ thuyên tắc mạch não trong phẫu thuật. Một khía cạnh quan trọng cần xem xét là loại stent, trong trường hợp có EPD, stent có thể không tác động đáng kể đến nguy cơ biến chứng trong thủ thuật, nhưng lại có thể đóng vai trò quan trọng trong việc ngăn ngừa các biến cố sau này do các mảng bám19. Theo đó, trong trong quá trình cắt bỏ nội mạc động mạch cảnh, các mảng xơ vữa và huyết khối được cắt bỏ hoàn toàn, tuy nhiên trong quá trình CAS, mảng bám động mạch cảnh được nén chặt vào thành và được giữ lại nhờ đặc tính bao phủ (scaffolding) và áp thành của stent. Do đó, nguy cơ các mảng bám gây thuyên tắc đoạn xa có thể bị ảnh hưởng bởi hình dạng thiết kế của stent, không chỉ trong quá trình làm thủ thuật (khi đặt EPD), mà còn trong 24 giờ sau thủ thuật và trong vòng 30 ngày sau thủ thuật, cho đến khi quá trình nội mô hóa hoàn tất. Đặc tính này của stent được gọi là “chống thuyên tắc nội tại”.
3.BẢO VỆ NÃO
•Các tổn thương động mạch cảnh đôi khi bao gồm huyết khối và các mảng loét có thể gây tắc trong quá trình can thiệp nội mạch như đã chỉ ra trong phân tích mô bệnh học 20 và các nghiên cứu Doppler xuyên sọ 21.
•Tắc mạch lớn (được định nghĩa là kích thước >100 μm ) thường là liên quan đến các biểu hiện lâm sàng, đặc biệt nếu kích thước >200 μm.
•Tác động của tắc mạch nhỏ (được định nghĩa là kích thước <100 μm) không thấy rõ và có thể bao gồm những thay đổi rất nhỏ trong các chức năng nhận thức thần kinh. Việc sử dụng EPD có liên quan đến việc giảm tải tắc mạch 22. Dữ liệu sơ bộ cho thấy kết quả lâm sàng của CAS có thể so sánh với các loạt kết quả phẫu thuật tốt nhất, khi EPD được áp dụng thường quy 23. Việc sử dụng EPD ngày nay được coi là một tiêu chuẩn khi theo đuổi một thủ thuật nội mạch an toàn.
•Một cách tuần tự và chuẩn hóa các đặc điểm giải phẫu và lâm sàng của bệnh nhân là điều cần thiết trong việc xác định các yếu tố có thể làm tăng các khó khăn kỹ thuật và rủi ro của CAS để tránh thất bại hoặc biến chứng điều trị. Dự đoán các tình huống bất lợi cho phép thủ thuật viên lựa chọn dụng cụ và kỹ thuật phù hợp nhất, tuân theo khái niệm “tailored approach – phương pháp phù hợp”.
III. ĐÁNH GIÁ TRƯỚC THỦ THUẬT
4. KHÁI NIỆM ”ĐOẠN ĐẶT STENT” (STENTING SEGMENT)
– Mục tiêu chính của CAS là ngăn chặn ảnh hưởng đến hệ thần kinh trong tương lai. Mục tiêu kỹ thuật của CAS là bao phủ toàn bộ mảng bám động mạch cảnh bằng stent, để lại tỷ lệ hẹp còn lại dưới 30%. Điều trị các tổn thương động mạch cảnh bằng cách đặt stent từ các đoạn động mạch “bình thường đến bình thường” là khái niệm cơ bản khi thực hiện CAS. Việc đánh giá đầy đủ các kịch bản giải phẫu bất lợi của phân đoạn “bình thường đến bình thường” này là mối quan tâm hàng đầu, vì phân đoạn mạch máu này sẽ tương tác với cấu trúc kim loại trần/nitinol trong và sau thủ thuật.
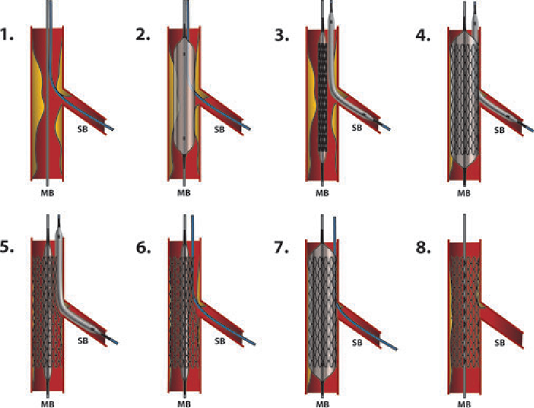
•“Stenting segment” được xác định bởi đoạn động mạch thẳng bao gồm tổn thương động mạch cảnh và đoạn động mạch “bình thường” tiếp giáp với tổn thương động mạch cảnh (đầu gần và đầu xa). (Hình 3) .
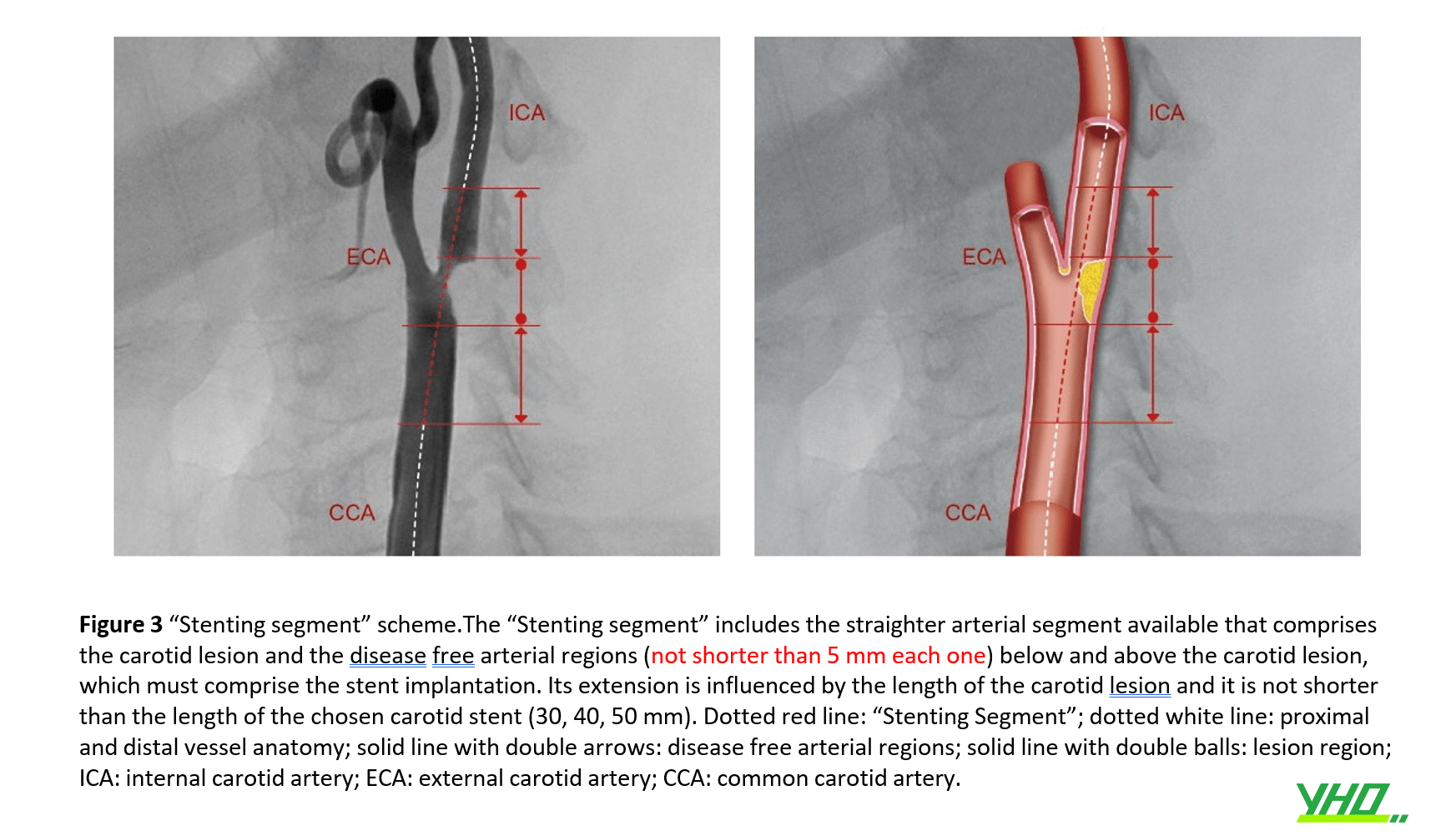
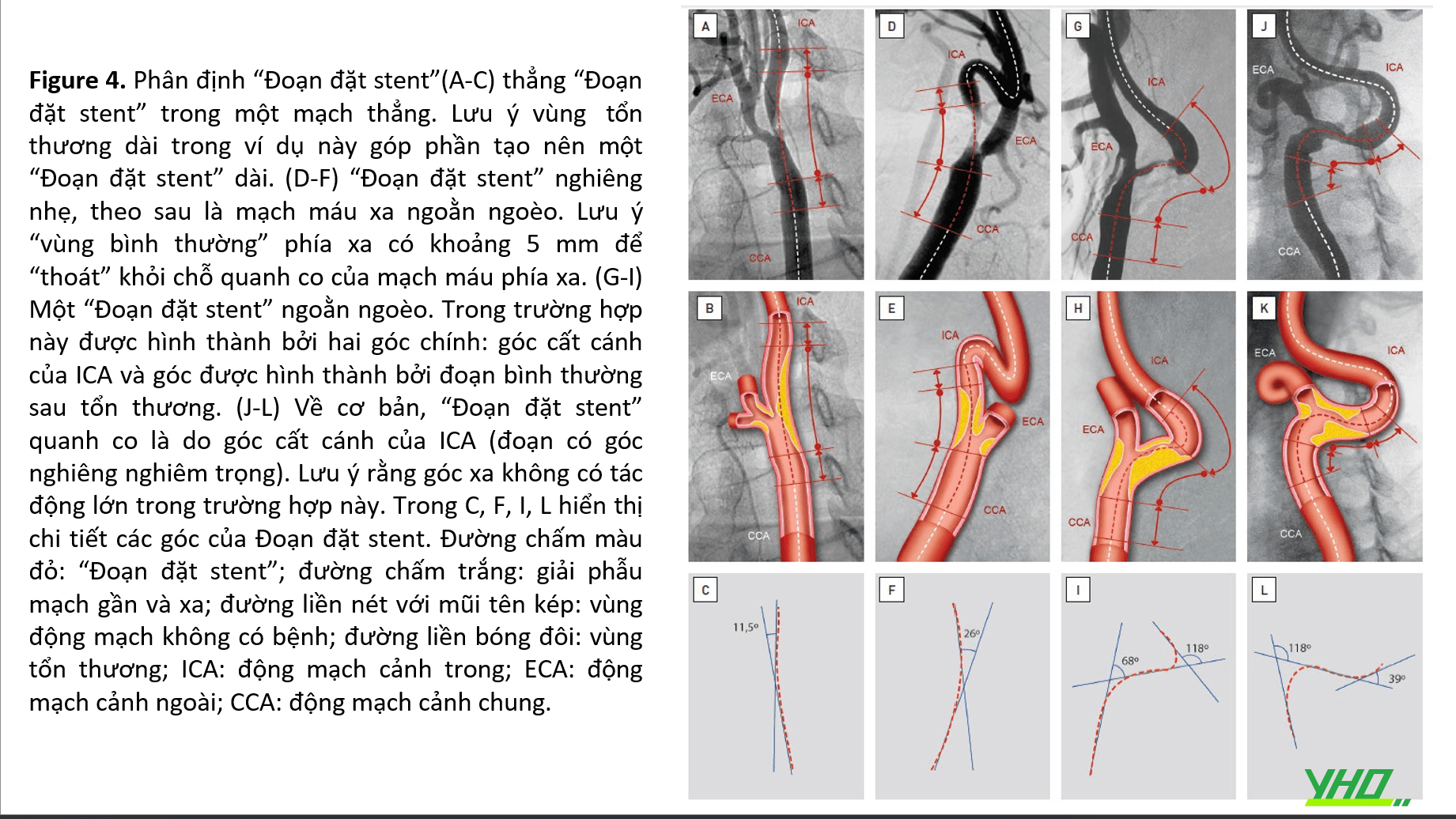
•Một số khía cạnh cơ bản của “đoạn đặt stent” được thể hiện trong Hình 4 . Trong nhiều trường hợp, một đường cong xa có thể tránh được nếu xem xét một “vùng bình thường” rất ngắn ở xa tổn thương động mạch cảnh, sao cho stent không “chạm” vào một đường cong nổi bật (Hình 4 D-E ). Năm milimét được coi là chiều dài ngắn nhất của vùng động mạch “bình thường” cần được bao phủ. Nếu bờ xa ở trước một đường cong xa ngắn hơn mức đó, thì đường cong đó nên được coi là một phần của “đoạn đặt stent” ( Hình 4 G-H).
Vì các tổn thương động mạch cảnh chủ yếu nằm ở hoặc rất gần với chỗ chia của động mạch cảnh, nên “đoạn đặt stent” phải luôn bao gồm cả nhánh động mạch cảnh.
5.KHÁI NIỆM “FIVE ARTERIAL ZONE – 5 KHU VỰC ĐỘNG MẠCH”
•Một số phân loại giải phẫu, phân chia động mạch cảnh trong (ICA) và các nhánh chính của nó, đã được đề xuất. Với việc đưa CAS vào thực hành hàng ngày, cần phải có một phân loại giải phẫu mới vì một số khía cạnh giải phẫu (chẳng hạn như động mạch cảnh chung [CCA] và giải phẫu cung động mạch chủ) không được xem xét trong các phân loại đó và chúng có tác động trực tiếp đến các nguy cơ có thể xảy ra của thủ thuật CAS. Một hệ thống danh pháp mới được đề xuất ở đây, dựa trên việc phân định năm khu vực động mạch, mỗi khu vực tương ứng với một bước thủ thuật của CAS: Phân loại “Năm khu vực động mạch”.
•Sau khi phân định “đoạn đặt stent”, có thể chia động mạch cảnh ngoài sọ thành ba vùng chính: vùng “mạch gần” (từ điểm xuất phát của CCA bên trái hoặc thân cánh tay đầu [BCFT] đến “đoạn đặt stent”); vùng “đoạn đặt stent” và vùng “mạch xa” (ICA từ “đoạn đặt stent” cho đến khi mạch đi vào hộp sọ). “Năm vùng động mạch” bao gồm ba vùng đó và giải phẫu cung động mạch chủ và mạch não truyền thống (ở đây được gọi là vùng “vòm động mạch chủ” và “mạch não”) (Hình 5).
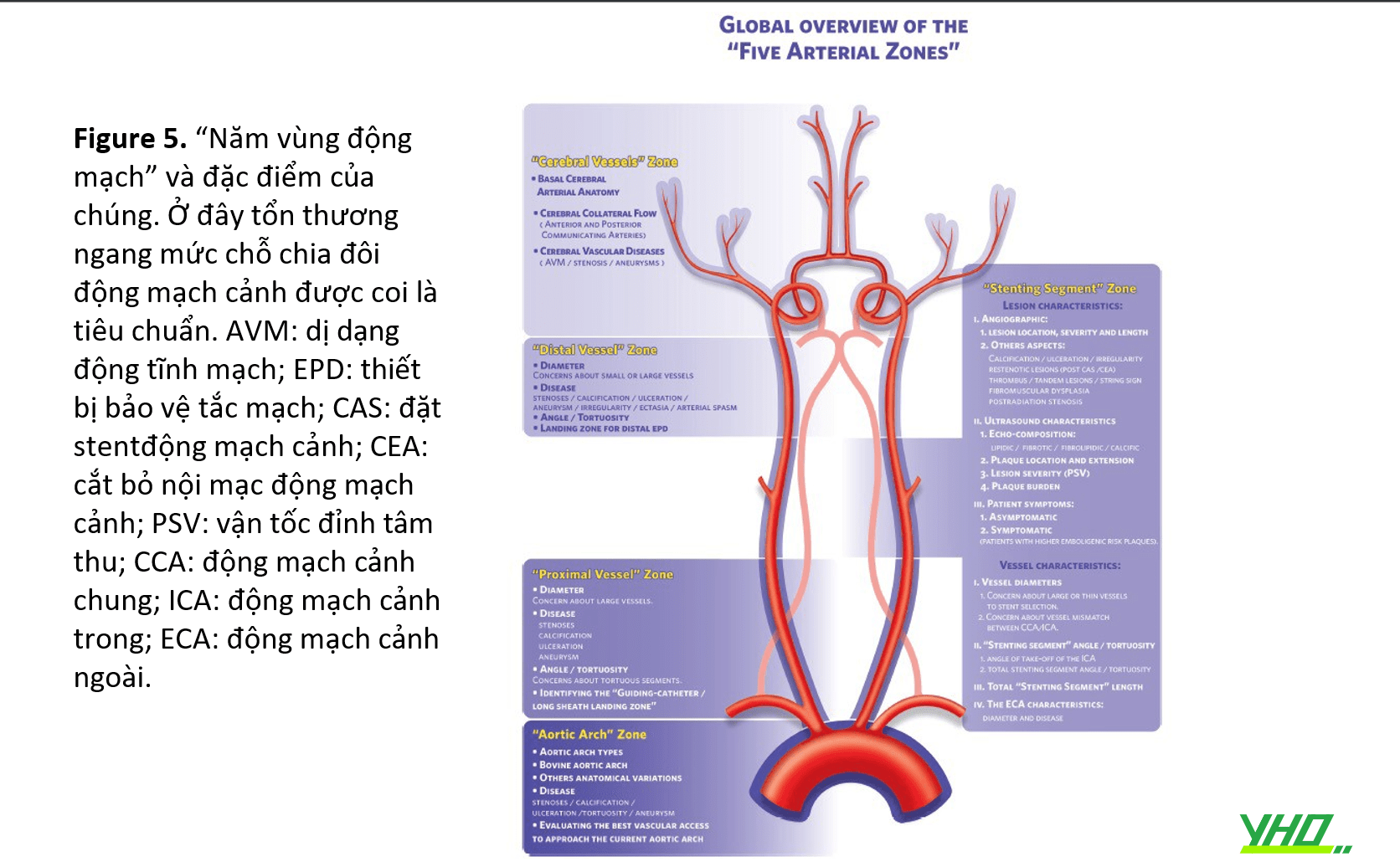
TƯƠNG QUAN “FIVE ARTERIAL ZONE” VỚI THỦ THUẬT “TAILORED CAS”
•Mỗi phân đoạn của “năm khu vực động mạch” có mối tương quan trực tiếp với một bước của thủ thuật CAS. Trong quá trình phân tích từng vùng mạch, cần lưu ý đến một liên kết cơ bản dưới đây:
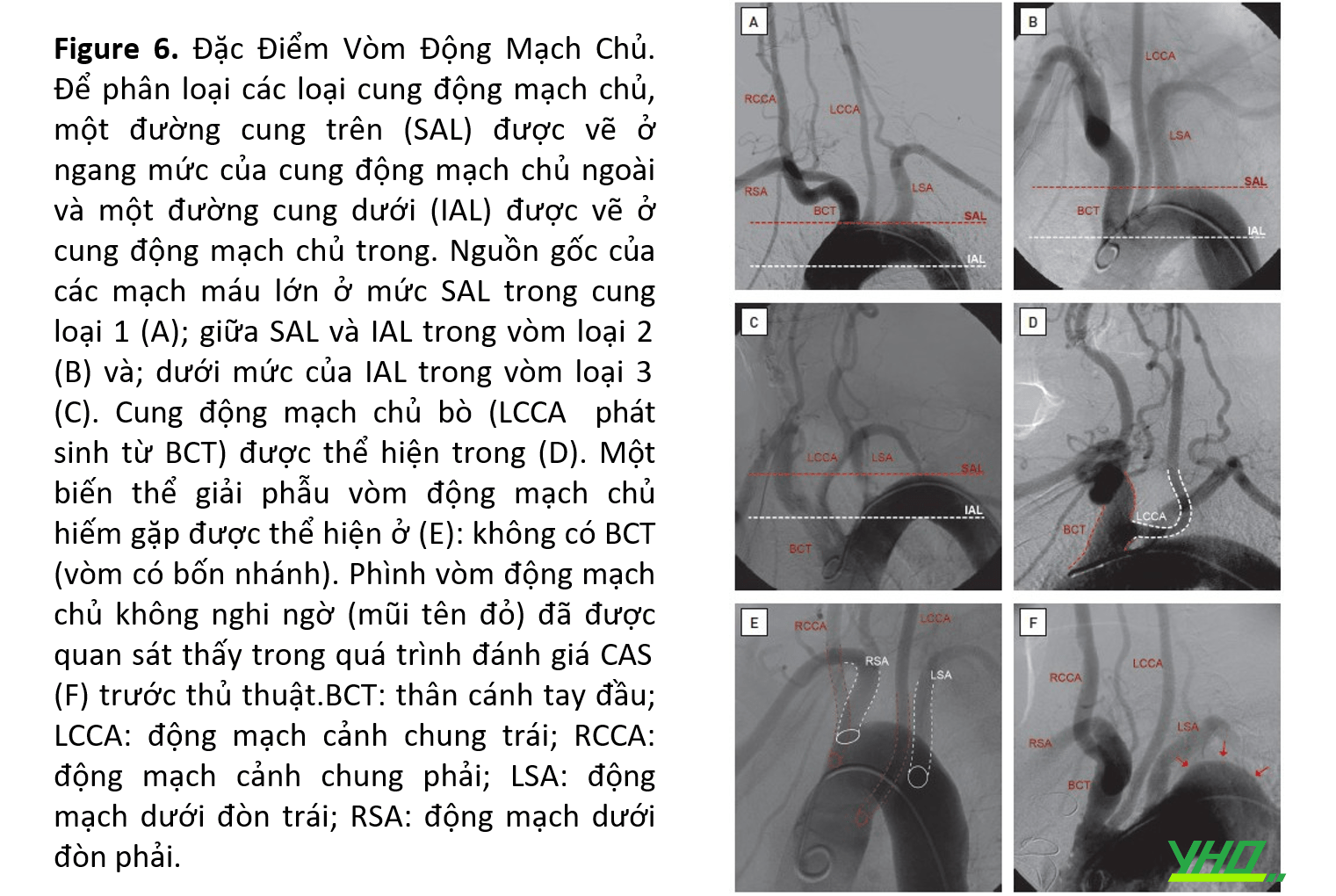
•Vùng “cung động mạch chủ” và “mạch gần” có liên quan đến việc dự đoán những khó khăn trong quá trình tiếp cận CCA và ổn định guiding catheter/guiding sheath. Việc đánh giá vùng này cần dựa vào đặc điểm của “cung động mạch chủ”:
-Phân loại cung động mạch chủ (Loại I, II và III);
-Các biến thể giải phẫu cung động mạch chủ;
-Mức độ xơ vữa/vôi hóa;
-Các bệnh lý khác như phình động mạch và loét (Hình 6).
•Các khu vực “đầu gần” và “đàu xa” có liên quan đến việc dự đoán những khó khăn trong quá trình đặt và thu hồi EPD gần hoặc xa. Việc đánh giá các vùng này bao gồm:
-Đường kính mạch;
-Độ gập góc, xoắn vặn và gấp khúc của mạch;
-Các bệnh mạch máu (xơ vữa động mạch, hẹp, loét, giãn tĩnh mạch, phình động mạch hoặc loạn sản sợi cơ);
-“Guiding catheter landing zone” trong CCA (đoạn động mạch được chọn để làm landing zone của
guiding catheter/ guiding sheath);
-“Landing zone” đầu xa của EPD trong ICA.
•Vùng “mạch máu não” có liên quan đến việc dự đoán những khó khăn trong giai đoạn nong trước thả, đặt stent và nong sau thả. Vùng này có ảnh hưởng trực tiếp đến việc lựa chọn đặc điểm kỹ thuật stent phù hợp và ảnh hưởng đến việc lựa chọn loại thiết bị bảo vệ não. Việc đánh giá vùng này bao gồm:
-Đặc điểm tổn thương động mạch cảnh:
-Đặc điểm chụp mạch;
-Đặc tính của Echo Doppler;
-Triệu chứng của bệnh nhân: mặc dù không phải là khía cạnh giải phẫu hay siêu âm, chúng tôi cố ý sắp xếp các triệu chứng bệnh nhân trong phần này vì bệnh nhân có triệu chứng thần kinh có tổn thương động mạch cảnh có nguy cơ thuyên tắc não cao hơn trong thủ thuật CAS;
-Đặc điểm mạch máu
•Tất cả những khía cạnh này được trình bày chi tiết trong Hình 5 .
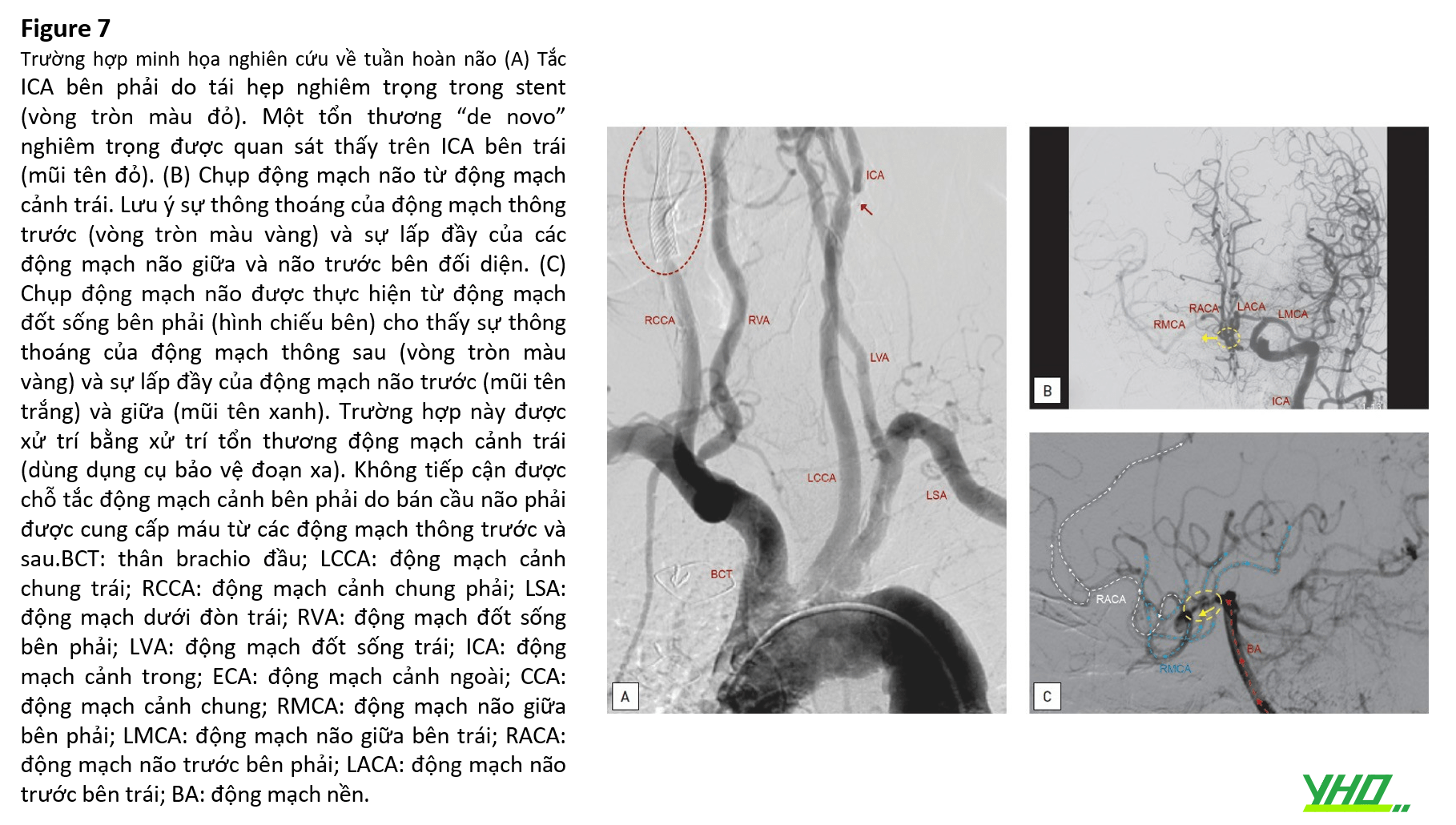
Vùng “mạch máu não” được liên kết để xác minh cấu trúc giải phẫu não cơ bản và mô hình dòng chảy bên (tính toàn vẹn của Circle of Willis) (Hình 7) và khả năng sử dụng EPD đoạn gần. Vùng “mạch máu não” được đánh giá theo: (a) bệnh lý mạch máu (hẹp, phình động mạch và dị dạng động tĩnh mạch) và (b) giải phẫu mạch máu nội sọ bằng cách xác định giải phẫu động mạch não nền và ưu thế bán cầu não. Khi nghi ngờ có một “bán cầu não bị cô lập”, nên kiểm tra dòng chảy phụ của não bằng cách xác minh sự thông thoáng của các động mạch thông trước và sau ( Bảng 4).
Hướng tới phương pháp đặt stent động mạch cảnh an toàn hơn
•Nhận biết trước tất cả các tình huống lâm sàng và giải phẫu có thể khiến bệnh nhân có nguy cơ cao phải đặt stent động mạch cảnh
•Cách tiếp cận động mạch cảnh chung một cách an toàn, lựa chọn và quản lý EPD, lựa chọn và đặt stent là những yếu tố chính để giảm các biến chứng của thủ thuật
IV. DỤNG CỤ BẢO VỆ NÃO
KẾT QUẢ LÂM SÀNG
•Việc so sánh hiệu quả giữa thủ thuật CAS có dụng cụ bảo vệ và không có dụng cụ bảo vệ được khảo sát trong một thử nghiệm ngẫu nhiên lớn được thực hiện và thật khó để tưởng tượng rằng một nghiên cứu như vậy sẽ tồn tại. Theo nghĩa này, dữ liệu tài liệu đã xuất bản chỉ cung cấp thông tin gián tiếp về nhu cầu đối với EPD.
•EPD thu giữ các mảng vụn có thể nhìn thấy được ghi lại trong 60% ca CAS bởi Sprouse
et al 31, và 66,8% bởi nhóm của chúng tôi 18.
•Nhóm của chúng tôi cũng quan sát thấy tỷ lệ biến chứng thuyên tắc giảm 79% với CAS 32
có dụng cụ bảo vệ.
•Một đánh giá của 1 khảo sát toàn cầu vào năm 2003 cho thấy tỷ lệ đột quỵ và tử vong lần lượt là 5,2% và 2,2% đối với CAS không có dụng cụ bảo vệ và có dụng cụ bảo vệ 33.
•CAS không có dụng cụ bảo vệ có liên quan đến tỷ lệ đột quỵ cao hơn 3,9 lần sau 30 ngày so với CAS có dụng cụ bảo vệ trong giai đoạn đầu của nghiên cứu EVA-3S 34.
•CAS có dụng cụ bảo vệ có tỷ lệ liệt nửa người cùng bên do đột quỵ thấp hơn đáng kể (1,7% so với 4,1%, p=0,007) trong Thử nghiệm đăng ký của Đức 35.
•Kastrup và cộng sự 36 đã xem xét các tài liệu liên quan đến kết quả ban đầu của CAS có và không sử dụng EPD trong các nghiên cứu được công bố từ năm 1990 đến 2002. Tỷ lệ tử vong và đột quỵ trong 30 ngày kết hợp là 5,5% và 1,8% đối với người không có dụng cụ bảo vệ (p=2.537) và các thủ tục CAS có dụng cụ bảo vệ (p=896) tương ứng (p<0,001).
•Trong một đánh giá gần đây, Garg et al đã phân tích 134 bài báo với tổng số 12.263 bệnh nhân CAS có dụng cụ bảo vệ và 11.198 bệnh nhân không có dụng cụ bảo vệ 37. Sử dụng phân tích tổng hợp của tất cả 134 báo cáo, họ nhận thấy nguy cơ đột quỵ tương đối là 0,62 (CI 95%: 0,54 – 0,72) nghiêng về CAS có dụng cụ bảo vệ . Phân tích phân nhóm cho thấy lợi ích đáng kể đối với CAS có dụng cụ bảo vệ ở cả bệnh nhân có triệu chứng và không có triệu chứng (p<0,05).
•Theo những dữ liệu này, thủ thuật CAS có dụng cụ bảo vệ liên quan đến việc giảm các biến chứng thuyên tắc do thủ thuật.
BẢO VỆ ĐẦU XA
•Cơ chế hoạt động của EPD đoạn xa dựa trên việc lọc hoặc làm gián đoạn lưu lượng máu của ICA, bằng cách đặt dụng cụ ở phía đầu xa của tổn thương, trong vùng được gọi là “landing zone” (phần xa của ICA ở ngoài sọ). Hệ thống EPD đầu xa đầu tiên được sử dụng bao gồm một quả bóng chặn dòng ICA, cho phép điều trị tổn thương mà không gây thuyên tắc trong mạch máu não. Hệ thống này ngày nay hiếm khi được sử dụng, được thay thế rộng rãi bằng các thiết bị lọc (Hình 8) do sự trực quan, dễ dàng sử dụng và hiệu quả hơn. Các thiết bị lọc giữ lại các mảnh vụn có kích thước từ trung bình đến lớn, thường là các hạt có kích thước
>100 μm . Hiệu suất của bộ lọc có thể được tóm tắt như cấu hình chéo và khả năng bắt dị vật. Tầm quan trọng cấu hình chéo của bộ lọc là dây và bộ lọc (như một đơn vị hoặc thậm chí độc lập với nhau) phải đi qua khu vực tổn thương mà không đánh bật các mảng bám dễ vỡ.
Khả năng bắt của bộ lọc chủ yếu phụ thuộc vào kích thước lỗ màng và vị trí vách thích hợp.

•EPD đoạn xa, hoặc là bóng bít tắc hoặc bộ lọc, đều có hạn chế là khu vực tổn thương không được bảo vệ khi các dụng cụ này đi qua, đặc biệt là ở những chỗ hẹp, nơi nguy cơ mảnh vỡ bị trật và tắc mạch tăng lên. Bung bóng tắc đoạn xa có thể chặn tắc mạch vi mô và tắc mạch lớn bằng cách làm tắc dòng ICA nhưng có thể dẫn đến tắc mạch thông qua các nhánh từ ECA đến động mạch não giữa. Ngoài ra, khoảng 5% đến 8% bệnh nhân không chịu được gián đoạn tưới máu não. Các thiết bị lọc không ngăn được vi thuyên tắc, bị giới hạn chủ yếu bởi kích thước lỗ lưới. Ở đoạn xa xoắn vặn hoặc ICA lớn, việc đặt dụng cụ áp thành mạch không phù hợp có thể cho phép các mảng bám lớn đi qua. Thực tế là các mảnh vụn có thể bị đánh bật (hiệu ứng ép) trong quá trình thao tác lấy bộ lọc. Cả hai hệ thống EPD ở xa có thể tự làm hỏng ”bãi đáp”, gây tắc mạch và các biến chứng khác như bóc tách và co thắt động mạch.
BẢO VỆ TẬN NƠI
•Các EPD đầu gần hoạt động bằng cách làm gián đoạn hoặc đảo ngược lưu lượng máu trong CCA/ICA. Chúng có ưu điểm là thúc đẩy sự giao nhau được bảo vệ của tổn thương và ngăn chặn cả tắc mạch lớn và tắc mạch vi mô . Thực tế là không có thao tác nào với dụng cụ trong ICA đoạn xa làm giảm nguy cơ co thắt động mạch, bóc tách hoặc tổn thương nội mạc.
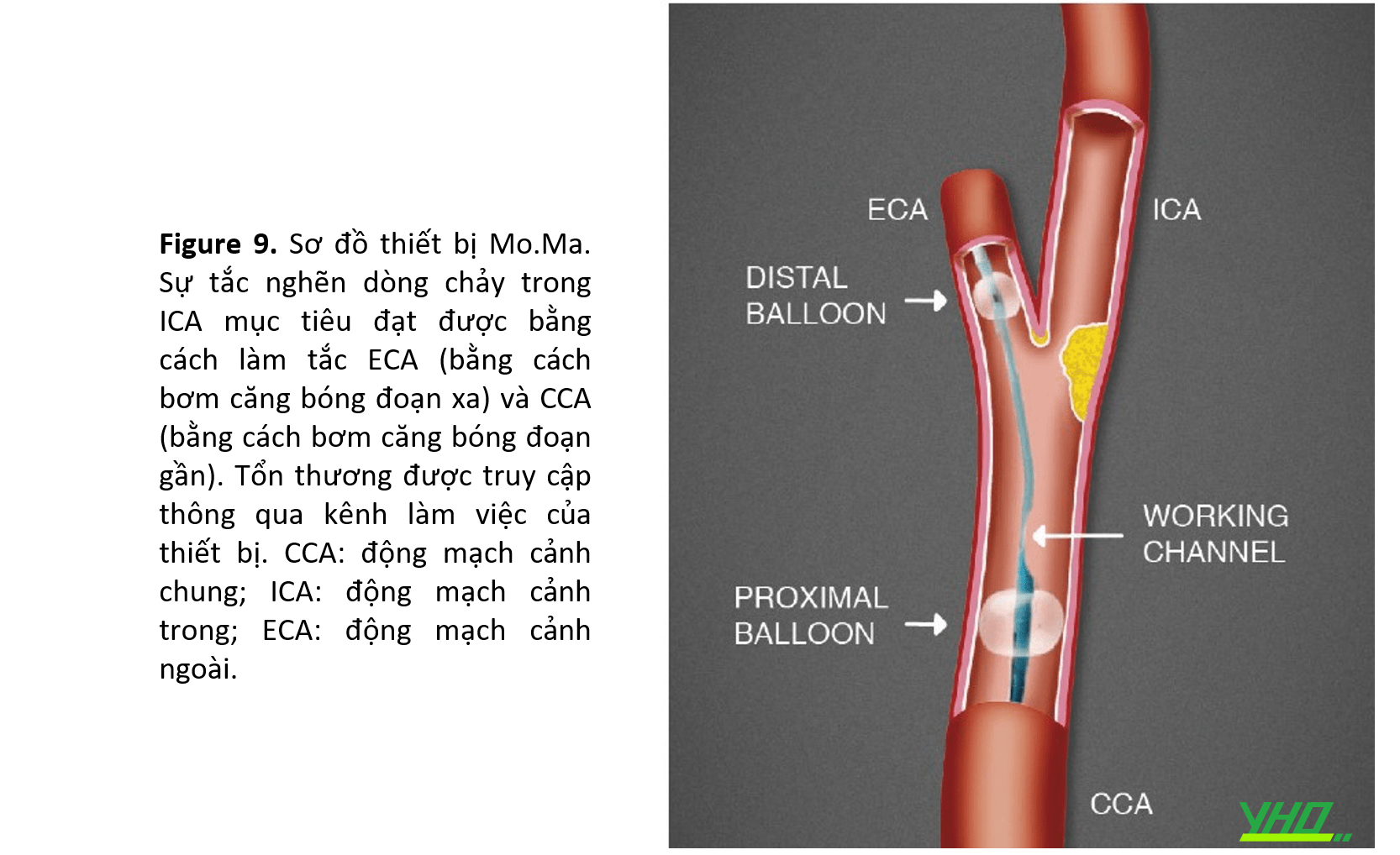
MO.MA® (MEDTRONIC, INC., MINNEAPOLIS, MN)
•Mo.Ma bao gồm một sheath 8 Fr hoặc 9 Fr với lòng (working channel) là 5 Fr và 6 Fr, với hai quả bóng bơm hơi độc lập (Hình 9) . Bóng đầu xa nằm gần đầu sheath và che kín ECA có đường kính lên tới 6 mm. Bóng đầu gần được đặt cách bóng xa gần 2 cm và bịt kín CCA có đường kính lên đến 13 mm. Khi được bơm căng, cả hai quả bóng đều ngăn dòng chảy thuận từ CCA và dòng chảy ngược từ ECA. Trong tình huống này, tổn thương động mạch cảnh có thể được cắt ngang và điều trị bằng phương pháp chặn dòng chảy, ngăn ngừa thuyên tắc não
. Sau khi điều trị tổn thương, ba ống tiêm máu 20 mm được hút tích cực và kiểm tra các mảnh vụn trước khi xì bóng ở vị trí đầu xa và đầu gần tương ứng.
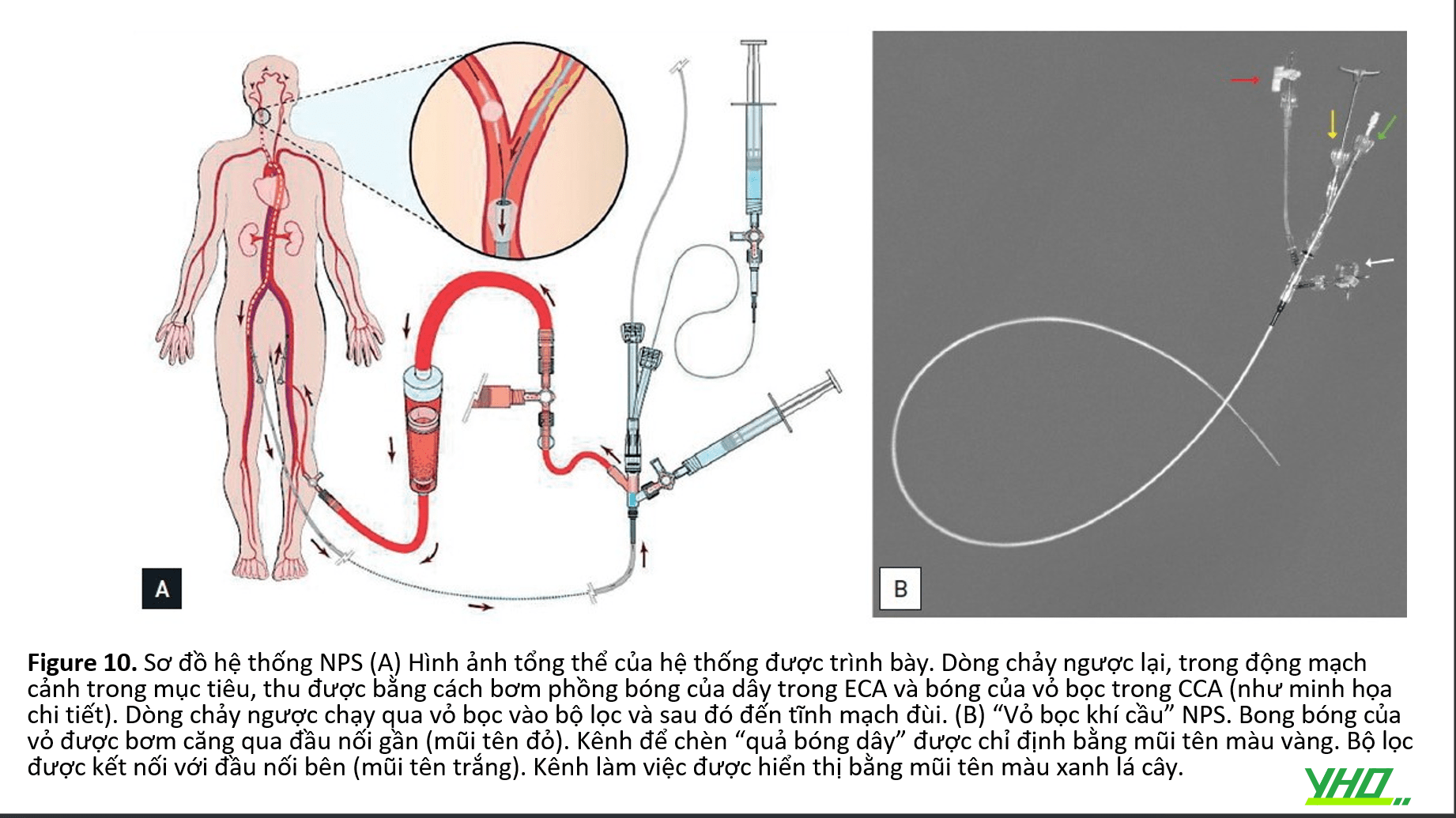
NEURO PROTECTION SYSTEM™ (NPS; WLGORE & ASSOCIATES, INC., FLAGSTAFF, AZ, USA)
•Hệ thống bảo vệ thần kinh, bắt nguồn từ Hệ thống chống thuyên tắc Parodi (PAES; ArteriA Medical Science, San Francisco, CA, USA), thúc đẩy dòng chảy ngược thụ động trong ICA. Nó bao gồm hai hệ thống độc lập: balloon wire và sheath 11 Fr (9 Fr trong hệ thống NPS mới), có kênh làm việc là 6 Fr và chứa một quả bóng ở đầu của nó (Hình 10) . Sheath được định vị trong CCA và dây bóng được luồn qua sheath và được đặt tại ECA. Khi cả hai quả bóng được bơm căng, dòng máu chảy qua CCA và ECA sẽ bị chặn. Phần gần nhất của vỏ được kết nối với tĩnh mạch đùi đối diện, cho phép máu chảy ngược dòng từ tuần hoàn não (qua Circle of Willis) xuống ICA và qua vỏ vào hệ thống tĩnh mạch. Dòng máu ngược đi qua một bộ lọc (kích thước lỗ 180 μm ) giữ lại các mảnh vụn trước khi máu quay trở lại tĩnh mạch đùi. Trong dòng chảy ngược, tổn thương động mạch cảnh có thể được cắt ngang và điều trị. Khi kết thúc quy trình, 10 ml máu được hút chủ động và sau đó các bóng được xì hơi trong khi lực hút chủ động được áp dụng để lấy bất kỳ hạt nào tiếp giáp với bộ phận làm tắc bóng .
•Có một thông báo trên trang web của công ty cho biết thiết bị này không có sẵn để đặt hàng kể từ ngày 1 tháng 10 năm 2013.
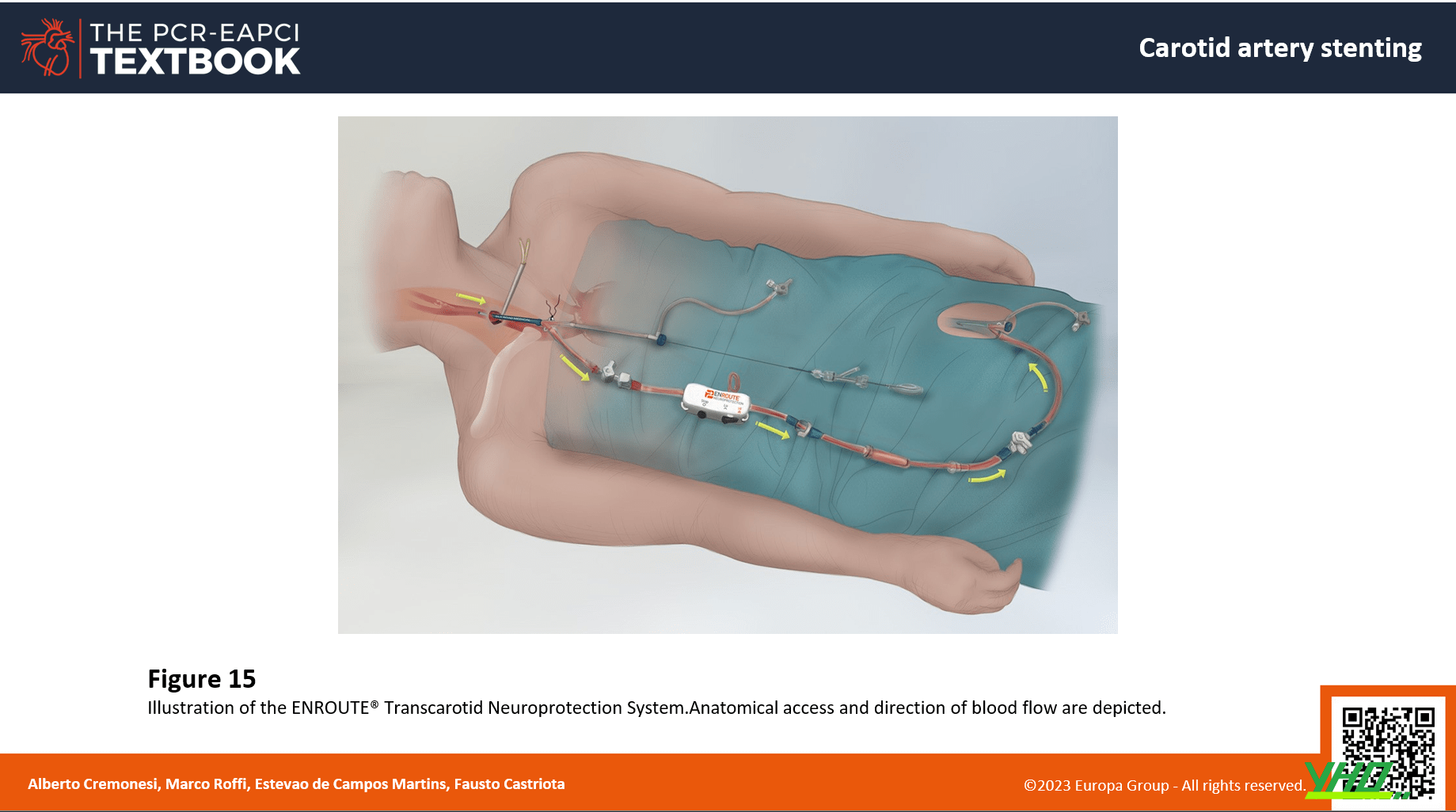
ENROUTE ® TRANSCAROTID (SILK ROAD MEDICAL)
•Thiết bị bao gồm một hệ thống đảo chiều dòng chảy mới bao gồm sheath động mạch, sheath tĩnh mạch và đường áp lực (có bộ điều chỉnh dòng chảy) ( Hình 15 ). Một sheath động mạch xuyên cổ 8F chuyên dụng (có ống nhánh bên) được thiết kế để đưa vào động mạch cảnh chung cùng bên thông qua một vết rạch phẫu thuật (tiếp cận trực tiếp) phía trên xương đòn (5 cm dưới chỗ chia đôi động mạch cảnh). Quá trình luồn sheath động mạch qua vòng của động mạch cảnh chung (gần chỗ rạch động mạch). Khi căng ra, vòng này sẽ ngăn dòng chảy xuôi trong động mạch cảnh chung, buộc máu ở động mạch cảnh chung ở đoạn xa, (và do đó từ các động mạch cảnh trong và ngoài) chảy ngược dòng vào vỏ động mạch. Sheath tĩnh mạch được luồn qua da vào tĩnh mạch đùi đối diện. Ống bên cánh tay của cả hai sheath (động mạch và tĩnh mạch) được kết nối với đường áp lực, tạo ra một shunt động tĩnh mạch. Trong đường áp lực, có một bộ điều khiển dòng chảy trong dòng, cho phép thủ thuật viên điều chỉnh tốc độ dòng chảy ngược (dòng chảy cao hoặc dòng chảy thấp) qua mạch hoặc thậm chí là tắc nghẽn dòng chảy tạm thời. Tất cả các giai đoạn thao tác với tổn thương (nối dây sang thương, nong trước, đặt stent và sau nong) được thực hiện dưới dòng chảy ngược qua vỏ động mạch.
BẢO VỆ ĐẦU GẦN TRONG CAS: KẾT QUẢ LÂM SÀNG
•Dữ liệu lâm sàng về NPS bắt nguồn từ hai phiên bản của hệ thống Parodi , tức là PAES phiên bản đầu tiên và NPS phiên bản mới nhất.
Parodi et al 38 24 đã báo cáo, vào năm 2005, hơn 200 bệnh nhân đầu tiên được điều trị có bảo vệ thần kinh bằng hệ thống PAES. Họ đã đạt được tỷ lệ thành công kỹ thuật là 98,5%, tỷ lệ đột quỵ và tử vong trong 30 ngày là 1,5% và dung nạp kẹp (clamping tolerance) là 3%. Một số nghiên cứu không ngẫu nhiên đã xác nhận hiệu quả của PAES trong việc ngăn ngừa các biến chứng tắc mạch 39.
Nghiên cứu lâm sàng
EMPiRE đơn nhánh, đa trung tâm, đã nghiên cứu việc sử dụng Hệ thống đảo
ngược dòng chảy GORE® ở 245 bệnh nhân có nguy cơ phẫu thuật cao đã trải qua CAS. Tỷ lệ đột quỵ và tử vong là 2,9% và không có bệnh nhân nào bị đột quỵ nặng. Tỷ lệ tử vong và đột quỵ ở các phân nhóm có triệu chứng, không có triệu chứng và trên 80 tuổi lần lượt là 2,6%, 3,0% và 2,6%40.
Hiệu quả của thiết bị Mo.Ma
•Trong một nghiên cứu so sánh 41 giữa hệ thống Mo.Ma và hệ thống lọc đầu xa (EPI FilterWire ; Boston Scientific, Natick, MA, USA), bằng cách quan sát các tín hiệu microrembolic (MES) với Doppler xuyên sọ trong quá trình thực hiện CAS, hiệu quả của Mo.Ma trong việc ngăn chặn vi tắc mạch được đánh giá theo năm bước sau: 1) định vị hệ thống bảo vệ; 2) đoạn hẹp; 3) bung stent; 4) nong bóng; 5) thu hồi thiết bị bảo vệ. Hệ thống Mo.Ma cho thấy số lần thao tác ít hơn đáng kể trong các bước từ 2 đến 4 khi so sánh với bộ lọc, trong khi không có sự khác biệt đáng kể nào được quan sát thấy trong các giai đoạn đầu tiên và cuối cùng.
•Trong nghiên cứu đa trung tâm PRIMUS 42 đã thử nghiệm thiết bị Mo.Ma ở 416 bệnh nhân đã trải qua CAS. Thành công về kỹ thuật đã đạt được trong 99% trường hợp, thời gian kẹp trung bình là 4,9 ± 1,1 phút, không dung nạp kẹp tạm thời được quan sát thấy ở 5,8% và các mảnh vỡ lớn được lấy ra ở khoảng 60% bệnh nhân. Tỷ lệ tích lũy các biến cố bất lợi sau 30 ngày theo dõi là 4,6%, với tỷ lệ đột quỵ nặng và tử vong là 0,7%.
•Thử nghiệm ARMOR đa trung tâm đã đánh giá tính an toàn và hiệu quả trong 30 ngày của EPD gần nhất với Mo.Ma ở 262 đối tượng (37 đối tượng tham gia và 225 đối tượng then chốt). Thành công của thiết bị là 98,2% và thành công của thủ thuật là 93,2%. Tỷ lệ các biến cố tim mạch và mạch máu não nghiêm trọng trong 30 ngày là 2,7% với tỷ lệ đột quỵ nghiêm trọng trong 30 ngày là 0,9%43.
•Kinh nghiệm sử dụng thiết bị Mo.Ma ở những người 80 tuổi gần đây đã được báo cáo. Từ năm 2005 đến 2009, tổng số 198 bệnh nhân 80 tuổi (39,4% có triệu chứng) đã được gửi đến CAS. Tỉ lệ thành công của thủ thuật đã đạt được trong mọi trường hợp. Tỷ lệ đột quỵ/tử vong tổng thể trong 30 ngày là 2,52% (1,61% ở người không có triệu chứng và 3,9% ở người có triệu chứng)44.
•Hiệu quả của Hệ thống bảo vệ thần kinh Transcarotid ENROUTE đã được thử nghiệm trong một thử nghiệm đa trung tâm:
•Nghiên cứu triển vọng, đơn nhánh và đa trung tâm ROADSTER (18 trung tâm) thử nghiệm tính an toàn và hiệu quả của dòng chảy ngược với hệ thống Enroute trong quá trình đặt stent động mạch cảnh ở những bệnh nhân có nguy cơ cao. Thử nghiệm bao gồm những bệnh nhân có triệu chứng và không có triệu chứng với tỷ lệ hẹp ≥ 50% và 70% tương ứng. Sáu mươi bảy bệnh nhân đã tham gia vào giai đoạn đầu (tối đa 5 bệnh nhân để thủ thuật viên tích lũy kinh nghiệm) và 141 bệnh nhân trong giai đoạn then chốt (với tổng số 208 bệnh nhân). Trong giai đoạn sau, 26% bệnh nhân không có triệu chứng và 75% không có triệu chứng. Việc lựa chọn stent động mạch cảnh tùy thuộc vào mô tả của thủ thuật viên. Các tác giả đã báo cáo một thiết bị cấp tính và tỷ lệ thành công kỹ thuật là 99%. Tỷ lệ tất cả các cơn đột quỵ trong nhóm quan trọng là 1,4%, đột quỵ và tử vong là 2,8%, và đột quỵ, tử vong và nhồi máu cơ tim là 3,5%.
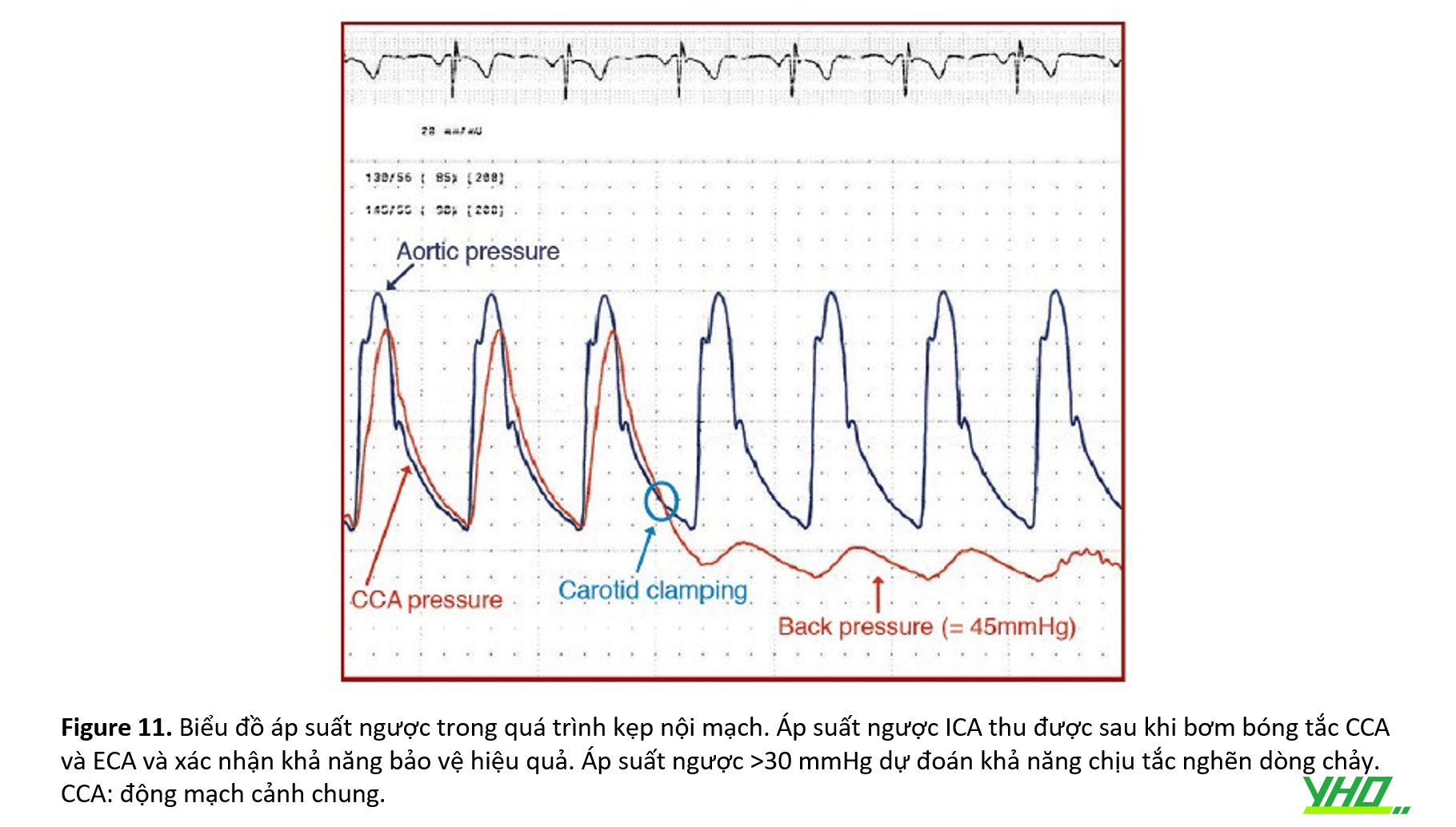
•GIỚI HẠN CỦA THIẾT BỊ ĐẦU GẦN
•Về cơ bản, nhược điểm của EPD đoạn gần so với EPD đoạn xa bao gồm: kích thước lớn; không dung nạp thần kinh do thiếu máu cục bộ do khả năng chịu đựng của bệnh nhân được thể hiện bằng áp suất ngược >30 mmHg (áp suất đo được trong hệ thống sau khi tắc cả bóng gần và bóng xa) ( Hình 11 ). Trong trường hợp clamping intolerance, ba chiến lược có thể được áp dụng trong suốt quá trình: (1) khẩn trương kiểm tra dụng cụ/hệ thống gây tắc mạch để phục hồi tưới máu não càng sớm càng tốt; (2) thực hiện quy trình từng bước trong đó bóng được bơm căng, kiểm tra máu và sau đó xì hơi bóng ở mỗi bước theo quy trình; và (3) sử dụng kỹ thuật “thắt dây an toàn và túi khí”, tức là đặt bộ lọc xa dưới sự bảo vệ ở đầu gần và sau đó xì bóng EPD ở đầu gần.
•Kinh nghiệm của thủ thuật viên tăng lên là yếu tố then chốt và ảnh hưởng trực tiếp đến thời gian kẹp tổng thể như đã thấy với thiết bị Mo.Ma (từ mười phút trong nghiên cứu của Diederich et al 46 đến năm phút trong PRIAMUS registry 42 .
ƯU VÀ HẠN CHẾ CỦA CÁC HỆ THỐNG BẢO VỆ KHÁC NHAU
•Thiếu sự so sánh trực tiếp giữa EPD đoạn gần và đoạn xa trong các thử nghiệm ngẫu nhiên lớn. Việc lựa chọn EPD tốt nhất nên được thực hiện theo khái niệm “phương pháp phù hợp” ( Bảng 4 ). Theo hướng dẫn chung, EPD đoạn gần nên được khuyến cáo mạnh mẽ ở những bệnh nhân có “vùng xa động mạch” bị gập hoặc bị bệnh và/hoặc không đủ landing zone. Ngoài ra còn dựa vào yếu tốt “đoạn đặt stent” có góc cạnh (như thể hiện trong Hình 4G-H) và/hoặc các tổn thương có nguy cơ tắc mạch cao hoặc hẹp. Sự không dung nạp của bệnh nhân là biến chứng được báo cáo phổ biến nhất liên quan đến các thiết bị này. Trong sổ đăng ký Mo.Ma , tổng cộng 7,1% bệnh nhân không dung nạp. Kỹ thuật xả bóng gián đoạn được sử dụng ở 1,9% bệnh nhân và sử dụng bộ lọc xa được áp dụng ở 0,6% bệnh nhân47.

•Các thiết bị lọc là lựa chọn đầu tiên ở những bệnh nhân bị tổn thương xơ hóa/vôi hóa, tắc động mạch cảnh đối diện (không bắt buộc), bán cầu não bị cô lập cùng bên, tắc động mạch cảnh ngoài và ở giai đoạn đầu của quá trình học tập của thủ thuật viên (do cách sử dụng trực quan của nó) ( Hình12). Co thắt và dòng chảy chậm là những biến chứng thường gặp nhất với các thiết bị lọc, với tỷ lệ được báo cáo lên tới 3,6% và 7,2% 48. Một thao tác giảm thiểu co thắt động mạch là sử dụng dây lọc có đầu mềm được xử lý nhẹ nhàng. Dòng chảy chậm xảy ra khi bộ lọc bị lấp đầy một phần hoặc hoàn toàn bởi các mảnh vụn. Dòng chảy dừng có thể gợi ý rằng một lượng lớn mảnh vụn đã bị bộ lọc giữ lại, vượt quá khả năng lưu trữ của nó trong quá trình thu hồi, gây ra nguy cơ tắc mạch lớn. Việc hút máu thông qua các ống thông chuyên dụng được đặt gần các bộ lọc có thể được khuyến nghị tích cực trong tình huống này để lấy lượng mảnh vụn quá mức.
•Bóc tách động mạch tại vùng đáp đã được mô tả trong 0,5% đến 0,9% trường hợp 49. Việc rút thiết bị đôi khi gây ra vấn đề, do sự tiến bộ của ống thông thu hồi qua các đoạn mạch xoắn vặn hoặc thậm chí qua các ống đỡ động mạch. Một số thao tác hữu ích là di chuyển cổ bệnh nhân (với mục tiêu thay đổi góc động mạch và các điểm kháng lực), sử dụng buddy wire hoặc thay đổi vị trí của hệ thống bằng cách đẩy ống thông can thiệp đến gần stent (không thể thực hiện thao tác này khi sử dụng ống luồn dài).
Bảo vệ não trong CAS
•Ưu điểm bộ lọc bảo vệ: thiết bị rất trực quan, duy trì tưới máu não
•Nhược điểm bộ lọc bảo vệ: : vượt qua tổn thương không được bảo vệ, cần có landing zone phù hợp trong ICA, vị trí thành mạch không đáng tin cậy, khó xác định giải phẫu quanh co và tổn thương kín
•Lợi thế bảo vệ đầu gần: được khuyến nghị trong các giải phẫu khó khăn (khó tiếp cận ICA do ICA-CCA xuất phát rất góc cạnh, ICA xoắn vặn, thiếu vùng đáp ở ICA phù hợp)
•Nhược điểm bảo vệ đầu gần: Tương thích introducer sheath 8-9 Fr (bệnh nhân mắc bệnh mạch máu ngoại biên), gián đoạn tưới máu não (không dung nạp với tắc nghẽn xảy ra trong 3-8% trường hợp)
•Các mảng xơ vữa và hình thái giải phẫu càng nguy hiểm thì việc sử dụng các thiết bị bảo vệ đầu gần càng cần được chỉ định
•Nhóm stent động mạch cảnh tự bung quan trọng thứ hai có cấu trúc nitinol (hợp kim niken-titan). Hầu hết các stent được làm từ một ống nitinol được cắt bằng laser để tạo ra một khung dạng lưới bao gồm các vòng hình khuyên thẳng hàng tuần tự, được kết nối với nhau theo kiểu xoắn ốc. Đặc tính của nitinol là cho phép giãn nở khi ở nhiệt độ khác nhau. Những đặc tính này cho phép nó mở rộng theo hình dạng và kích thước được xác định trước khi tiếp xúc với nhiệt độ cơ thể. Nhóm nitinol có thể được chia thành bốn loại thiết kế chính: khung mở, khung kín, thiết kế lai và stent hai lớp (chi tiết bên dưới). Stent nitinol được sản xuất có dạng hình trụ hoặc hình côn.
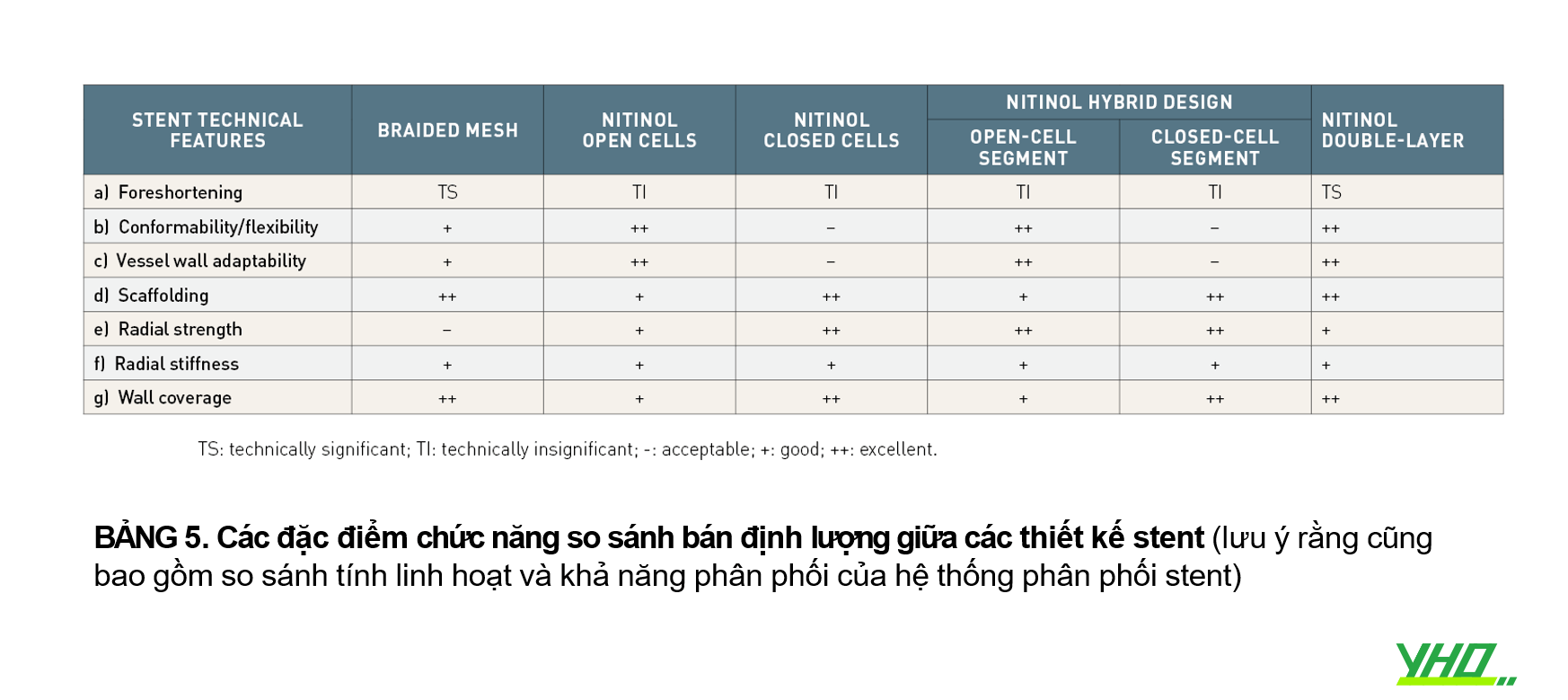
Một ưu điểm của stent nitinol là rút ngắn tối thiểu trong quá trình thả và lực hướng tâm hướng ra ngoài cao hơn khi so sánh với stent lưới bện. Trong nhóm nitinol, mắt cáo khung stent mở có diện tích phần khung tự do lớn hơn, tính phù hợp, tính linh hoạt và khả năng thích ứng với thành mạch cao hơn khi so sánh với các thiết kế mắt cáo khung stent kín. Những nhược điểm của stent thiết kế khung mở bao gồm scaffolding vừa phải và sự sai lệch của thanh chống stent trong các tổn thương động mạch cảnh phức tạp. Stent nitinol khung kín có lợi thế về scaffolding cao hơn cũng như đặc tính bao phủ thành và lực hướng tâm ra bên ngoài cao hơn, khi so sánh với stent nitinol khung hở. Nhược điểm của stent khung kín là độ cứng của thiết bị, cả trong quá trình đưa vào hệ thống phân phối và sau khi thả, cũng như tính phù hợp và tính linh hoạt kém. So sánh các đặc điểm chức năng giữa các thiết kế stent được thể hiện trong Bảng 5
LỰA CHỌN STENT
•Việc lựa chọn thiết kế stent trong các trường hợp đơn giản (cung động mạch chủ loại 1, giải phẫu trên động mạch chủ đơn giản, “đoạn stent” thẳng, mảng xơ ổn định) có thể không quan trọng. Ngược lại, các kịch bản giải phẫu đầy thách thức sẽ khiến thủ thuật viên hướng tới việc áp dụng phương pháp phù hợp (Bảng 4). Theo khái niệm này, lưới bện hợp kim coban và stent nitinol hai lớp là lựa chọn đầu tiên khi cần che phủ mảng bám và ngăn ngừa sa mảng bám tác dụng lâu dài (theo yêu cầu của các tổn thương dài, mềm và không đồng nhất), chủ yếu là do thuộc tính scaffolding. Bosier cộng sự 54 đã chứng minh lợi ích rõ ràng của stent scaffolfing và độ che phủ của thành trong việc giảm các biến chứng thần kinh sau thủ thuật cho bệnh nhân có triệu chứng ( mảng nguy cơ cao).
•Stent khung hở nitinol là lựa chọn đầu tiên khi gặp trường hợp động mạch cảnh phân nhánh, phức tạp và có mảng xơ vữa (được biểu thị bằng một “đoạn stent” có góc cạnh) đòi hỏi độ linh hoạt cao trong mạch stent và các đặc tính phù hợp với thành/mảng bám, do nhu cầu duy trì giải phẫu ban đầu của mạch máu xoắn vặn.
•Khi cần lực hướng tâm ra ngoài của stent, chẳng hạn như trong các tổn thương động mạch cảnh bị vôi hóa hoặc kháng thuốc, stent khung kín nitinol là một giải pháp tuyệt vời.
ĐỔI MỚI TRONG THIẾT KẾ STENT
•Cristallo _ Ideale ™ ( Invatec ) là một stent tự nở bằng nitinol kết hợp với cấu trúc stent lai, được thiết kế ô hở ở đoạn xa và đoạn gần và thiết kế ô kín ở đoạn giữa. Với cấu trúc này, tính linh hoạt và khả năng thích ứng của stent được đảm bảo bởi các ô mở (ở phần xa và phần gần) và các đặc tính bao phủ thành và giàn giáo cao của stent đạt được nhờ các ô kín (đoạn giữa). Stent này được tải trong hệ thống phân phối 5 Fr.
•Cristallo Registry 55 là một nghiên cứu đa trung tâm đã đánh giá tính an toàn và hiệu suất của stent lai trong điều trị hẹp ICA. Tiêu chí đánh giá chính là tỷ lệ các biến cố thần kinh bất lợi nghiêm trọng trong 30 ngày, được định nghĩa là đột quỵ nặng và nhẹ và tử vong. Trong số 124 bệnh nhân, không có biến cố thần kinh nghiêm trọng nào được tìm thấy và trải qua hai lần TIA (1,6%), cả hai đều xảy ra trong giai đoạn hậu phẫu. Điểm cuối phụ là thành công về mặt kỹ thuật, được định nghĩa là khả năng triển khai stent tại vị trí tổn thương mục tiêu với đường kính còn lại của hẹp < 30%, và thành công về quy trình, được định nghĩa là thành công về mặt kỹ thuật mà không có các biến cố thần kinh nghiêm trọng trong quy trình. Thành công về kỹ thuật và thủ thuật đã đạt được ở tất cả các bệnh nhân tham gia (100%). Ba bệnh nhân (2,5%) tử vong (tử vong không do thần kinh) trong thời gian nghiên cứu (hai bệnh nhân liên quan đến phổi và một bệnh nhân liên quan đến tim): tất cả những ca tử vong này đều không liên quan đến thiết bị cũng như biến chứng liên quan đến thủ thuật.
•Dòng sản phẩm thiết kế nitinol khung mở ViVEXX ™ (CR Bard Inc., Murray Hill, NJ, USA), được nạp vào hệ thống chuyển có kích thước 5 Fr, bao gồm nhiều kích cỡ, phù hợp với đường kính mạch CCA lớn lên đến 12mm.
•Một stent có hệ thống chuyển van 5 Fr (tương thích với stent có đường kính từ 5 đến 8 mm) là stent Precise “mới” (Precise® PRO RX®; Cordis Corp., Warren, NJ, USA), một nitinol khung mở với thiết kế stent có diện tích cell tự do nhỏ nhất trong số các stent nitinol cùng loại.
•Loại stent nitinol hai lớp đặc trưng bởi lưới hai lớp được phát triển gần đây. Một lớp bao gồm cấu trúc nitinol tự nở (cung cấp scaffoding linh hoạt) và lớp thứ hai, lưới bên trong/bên ngoài, được thiết kế để đạt được độ bao phủ cao lên mảng bám. Các thành phần của lớp lưới khác nhau tùy thuộc vào hai nhà sản xuất: Roadsaver ® Carotid Stent (Terumo) có lớp lưới siêu nhỏ bằng hợp kim nitinol (cả hai lớp đều bằng nitinol) và InspireMD Hệ thống ngăn ngừa thuyên tắc động mạch cảnh CGuard TM ( InspireMD ) có lưới siêu nhỏ bao gồm Polyethylene Terephthalate. Ưu điểm của thiết bị sau này là nó hoạt động như một ống đỡ động mạch và giúp phòng ngừa thuyên tắc. Thử nghiệm CGuard CARENET (Bảo vệ thuyên tắc động mạch cảnh bằng MicroNet ) 56 bao gồm 30 bệnh nhân tại 4 trung tâm ở Đức và Ba Lan và đánh giá tính khả thi của hệ thống CGuard . Các thiết bị bảo vệ đã được sử dụng trong tất cả các thủ thuật. Thủ thuật thành công là 100%, với 0% biến chứng. Tỷ lệ biến cố mạch máu não hoặc tim nghiêm trọng trong 30 ngày là 0%. Trải nghiệm với Roadsaver ® Stent cũng mới bắt đầu 57. Vẫn còn phải chứng minh trong các nghiên cứu lớn hơn nhằm để giảm các biến cố bất lợi trong thủ thuật nhiều hơn so với các thiết kế stent khác hay không.
Lựa chọn stent
•Lựa chọn stent phù hợp đóng một vai trò quan trọng không chỉ để đạt được kết quả tốt mà còn có kết quả cải thiện sau 30 ngày
•Stent có thể phát huy đặc tính chống tắc mạch nội tại
•Đối với thiết kế ô hở, kích thước ô càng lớn thì khả năng thâm nhập của mảng bám và sa vào thanh chống càng cao
•Mảng bám và giải phẫu phân nhánh càng rủi ro thì việc sử dụng scaffolding cao và khung có độ tương thích cao được chỉ định
VI. KỸ THUẬT TỪNG BƯỚC CỦA CAS
QUY TRÌNH LÂM SÀNG
THUỐC TRƯỚC THỦ THUẬT
•Sử dụng liệu pháp kháng tiểu cầu kép với aspirin và clopidogrel (hoặc ticlopidin) bắt đầu năm ngày trước khi làm thủ thuật (lí tưởng) và tiếp tục trong ít nhất 30 ngày, sau đó ngưng clopidogrel.
ĐÁNH GIÁ LÂM SÀNG
•Đánh giá các yếu tố nguy cơ xơ vữa động mạch và bệnh lý đi kèm của bệnh nhân: tuổi, giới tính, chủng tộc, tăng huyết áp, rối loạn lipid máu, đái tháo đường, đang hút thuốc (kể cả 5 năm trước), bệnh tim thiếu máu cục bộ suy tim sung huyết, suy thận và bệnh phổi nặng.
•Đánh giá thần kinh: cần được đánh giá bởi một bác sĩ chuyên khoa thần kinh có chuyên môn về đột quỵ, hoặc bởi một bác sĩ được chứng nhận bởi Viện Y tế Quốc gia về Đánh giá Đột quỵ (NIHSS) nhằm để xác định cơn thiếu máu não thoáng qua (TIA), đột quỵ, hoặc các triệu chứng thiếu máu cục bộ ở mắt trong vòng 6 tháng 59.
-Xác định các tình huống lâm sàng khẩn cấp như “TIA tăng dần” (TIA nhiều lần tái phát trong vài giờ đến vài ngày) và “đột quỵ đang tiến triển”.
-Xác định (1) số lần dựa trên chỉ số đến lần điều trị và (2) thời gian từ lần đột
quỵ gần nhất đến lần điều trị.
•Ở những bệnh nhân có tiền sử đột quỵ, nên đánh giá thêm dựa trên:
-Sự khác biệt về mức độ nghiêm trọng của đột quỵ là nhẹ (3 điểm trở xuống dựa trên NIHSS) hay đột quỵ major (4 điểm trở lên dựa trên NIHSS).
-Đánh giá kết quả chức năng sau 6 tháng của đột quỵ là không tàn tật, tàn tật
(mất chức năng từ 2 điểm trở xuống theo thang điểm Rankin sửa đổi) hoặc đột quỵ tử vong (không phải trường hợp ở đây).
ĐÁNH GIÁ HÌNH ẢNH TRƯỚC THỦ THUẬT
•Duplex scan động mạch cảnh.
•Chụp CTA/MRA cung động mạch chủ + động mạch cảnh + động mạch não
•Chụp CT/MRI để phát hiện nhồi máu não “thầm lặng”.
ĐÁNH GIÁ RỦI RO TTRƯỚC THỦ THUẬT
•Đánh giá các đặc điểm của “năm khu vực động mạch” để lường trước những khó khăn và rủi ro về mặt kỹ thuật theo quy trình nhằm hoạch định chiến lược tiếp cận phù hợp như đã nhận xét ở trên.
CÁC PHÉP ĐÁNH GIÁ CHUNG
•Tựa đầu và không dùng thuốc an thần, với đánh giá thần kinh trong quá trình thực hiện bằng các thông số chuyển động và giao tiếp đơn giản.
•Các thông số sinh tồn.
•Heparin IV 70 U/kg (ACT 250-300 giây).
KỸ THUẬT CAS
TIẾP CẬN MẠCH
•Động mạch đùi là đường tiếp cận chuẩn cho thủ thuật ở động mạch cảnh, nhưng trong trường hợp mạch máu quá xoắn vặn, hẹp nặng hoặc tắc động mạch đùi/chậu hoặc động mạch chủ bụng, thì phương pháp tiếp cận mạch quay có thể sử dụng thay thế(Hình 13). Trong tình huống cuối cùng này thì cần xác định rõ độ tương thích của dụng cụ và có kế hoạch can thiệp tối ưu và nên ưu tiêng sử dụng oowng luồn can thiệp dài. Theo nguyên tắc chung, CCA được tiếp cận từ mạch quay đối bên.
ĐÁNH GIÁ HÌNH ẢNH CƠ SỞ
•Trong trường hợp không đánh giá cung động mạch chủ trước đó (angiography hoặc CTA/MRA), chụp cung động mạch chủ được thực hiện thông qua một ống thông đuôi lợn đặt ở phần xa của động mạch chủ lên, ở góc chếch trước trái 30º đến 45º để thấy rõ nhất gốc của các mạch trên động mạch chủ và cùng một góc chiếu với thì động mạch cảnh. Góc chếch trước phải (≈ 30º) cho thấy sự phân nhánh của thân cánh tay đầu, tạo điều kiện thuận lợi cho việc đặt ống thông CCA bên phải. Động mạch cảnh (CCA, chỗ chia động mạch cảnh, ECA và ICA) sau đó được đánh giá trong ít nhất hai gốc chiếu thẳng gốc để xác định chỗ “mở” tối ưu của gốc ICA và ECA và để khảo sát tối đa tổn thương. Chụp mạch máu não là một phần thiết yếu của quá trình đánh giá vì nó có thể tiết lộ các dị dạng động tĩnh mạch, phình động mạch não và hẹp động mạch, và đóng vai trò như một thông số so sánh với chụp mạch não sau can thiệp để xác định các nguồn gây tắc mạch. Chụp 4 mạch não để đánh giá sự thông thoáng của Vòng Willis (thông qua các động mạch thông trước và sau) chỉ được thực hiện khi dự kiến sử dụng EPD đoạn gần ở những bệnh nhân bị tắc động mạch cảnh đối bên hoặc khi nghi ngờ bán cầu não bị cô lập cùng bên.
Lưu ý “năm vùng động mạch”, đánh giá tất cả các gốc chụp mạch và những nguy cơ để có một quy trình điều trị an toàn.
ĐỘNG MẠCH CẢNH CHUNG CÙNG GỐC XUẤT PHÁT
•Một trong những khía cạnh kỹ thuật quan trọng nhất của thủ thuạt CAS là đạt được sự an toàn và ổn định của CCA. Hai kỹ thuật tiêu chuẩn là sử dụng guiding catheter và guiding sheath.
•
Kỹ thuật sử dụng ống thông can thiệp (guiding catheter): tùy theo cấu hình cung động mạch chủ, một ống thông can thiệp dài 90-100 cm (8 Fr) được chọn để tiếp cận tốt nhất với các mạch trên động mạch chủ.
•Ống thông can thiệp đầu mềm góc 40º được sử dụng cho giải phẫu đơn giản. Ống thông được đưa nhẹ nhàng đến giữa CCA, qua một hoặc nhiều dây dẫn ái nước tiêu chuẩn có góc cạnh mềm được đặt ngay bên dưới chỗ chia đôi động mạch cảnh.
•Khi xử lý một giải phẫu phức tạp, chẳng hạn như cung động mạch chủ loại 3 hoặc cấu hình dạng tim bò (bovine) với CCA bên trái cùng gốc xuất phát BCT nên chọn ống thông cong có góc cạnh như ống thông can thiệp dạng gậy khúc côn cầu.
•Trong giải phẫu mạch xoắn vặn hoặc cung động mạch chủ ngược, một kỹ thuật hữu ích là dùng nhiều dây 0,035” đặt trong động mạch đích để tăng trợ lực cho ống thông (Hình 13C). Ngoài ra còn có thể sử dụng dây dẫn 0,014” trong ECA để tăng tính ổn định của toàn bộ hệ thống trong quá trình can thiệp (Hình 13E).
•Ưu điểm lớn của kỹ thuật đặt ống thông can thiệp là khả năng điều khiển, không chỉ để gắn CCA mà còn giải quyết các khó khăn trong quá trình thực hiện (chẳng hạn như khó khăn đã đề cập trong việc đưa ống rút qua stent để rút bộ lọc). Cần chú ý đến nguy cơ thuyên tắc đoạn xa do thao tác đặt ống thông qua cung động mạch chủ. Nguy cơ này có thể được giảm thiểu bằng cách thao tác nhẹ nhàng và chậm rãi khi xoay chuyển ống thông (biên độ nhỏ theo chiều kim đồng hồ và ngược chiều kim đồng hồ), thông qua dây 0,035”.
Một nhược điểm của kỹ thuật này là cần có sheath lớn (thường lớn hơn 2Fr so với sử dụng guiding sheath) do đó tăng nguy cơ biến chứng mạch máu.
•Có thể sử dụng ống luồn can thiệp (guiding sheath) thay cho ống thông can thiệp (guiding catheter).
Có một số kỹ thuật để cài ống luồn 1 cách an toàn vào CCA. Mô tả dưới đây là kỹ thuật tiêu chuẩn được sử dụng bởi trung tâm của chúng tôi, theo ý kiến của chúng tôi thì có một số ưu điểm so với các kỹ thuật khác, về cơ bản là sự giám sát của ECA với việc bằng cách sử dụng ống thông dẫn hướng 5 Fr.
Một ống thông can thiệp FR4 5F 100 cm được luồn qua dây dẫn ái nước 0,035” đầu mềm vào CCA. Ống thông can thiệp cho phép tiêm thuốc cản quang ngay cả khi có dây dẫn 0,035” bên trong, giúp “thấy đường đi”, so với “kỹ thuật mù” khi sử dụng ống thông chẩn đoán với dây 0,035”.
Chụp mạch để xác định chỗ chia đôi động mạch cảnh và sau đó đưa dây dẫn ái nước tới đoạn xa ECA (tránh đặt vào động mạch lưỡi vì nguy cơ tắc nghẽn đường thở đe dọa tính mạng do khối máu tụ lớn ở lưỡi trong trường hợp có thủng mạch máu). Giữ dây dẫn ở một vị trí cố định, ống thông can thiệp được đẩy sâu vào ECA cho đến khi ở vị trí ổn định. Nếu cần thêm trợ lực, dây 0,018” cũng có thể được sử dụng cùng với dây 0,035”. Tại thời điểm này, dây tiêu chuẩn 0,035” được đổi thành support wire 0,035 dài 260-300cm.
•Sau đó, ống thông can thiệp được rút ra và một ống luồn dài (long sheath) được luồn qua dây dẫn 0,035” vào giữa CCA.
Trong thực tế, việc lắp thiết bị Mo.Ma tuân thủ nghiêm ngặt tất cả các bước được mô tả ở trên (kết hợp các khía cạnh chức năng của EPD đầu gần vào shuttle sheath), chỉ khác ở việc đưa đầu xa vào ECA (thông qua dây dẫn cứng 0,035”), nơi bóng đầu xa được kiểm tra để xác nhận tắc ECA.
•Ưu điểm của kỹ thuật sử dụng ống luồn dài là sự an toàn khi đạt được vị trí ổn định trong CCA và với đường kính sheath yêu cầu nhỏ hơn (6 Fr). Nhược điểm là khả năng điều khiển (steerability) của nó bị giảm, tuy nhiên có thể phần nào cải thiện bằng cách sử dụng kỹ thuật kính thiên văn (telescope), sử dụng ống thông chẩn đoán (có đường cong mong muốn) đưa qua ống luồn can thiệp (trên dây dẫn 0,035”) trước để tiếp cận động mạch và sau đó hoạt động như một đường ray để cho phép đẩy ống luồn can thiệp dễ dàng hơn. Trong 1 số trường hợp, khi mà CCA xoắn vặn, sheath có thể bị gấp khúc, và thậm chí các quai động mạch có thể nổi rõ và/hoặc di lệch đầu. Ngoài ra, khi ECA bị tắc, kỹ thuật này có thể trở nên rủi ro hơn nhiều, đòi hỏi một kỹ thuật thay thế bao gồm tạo thủ công định dạng “đuôi lợn” trên đầu mềm của dây cứng 0,035”, nhằm mục đích rời “đuôi lợn” ” đầu gần chỗ chia đôi động mạch cảnh và phần cứng của dây ở giữa CCA để cung cấp đủ trợ lực cho sheath.
QUẢN LÝ EPD
•Việc sử dụng EPD đã được thảo luận trong phần có liên quan. Chọn loại thích hợp và xử lý đúng EPD là một trong những điểm chính để thủ thuật CAS thành công .
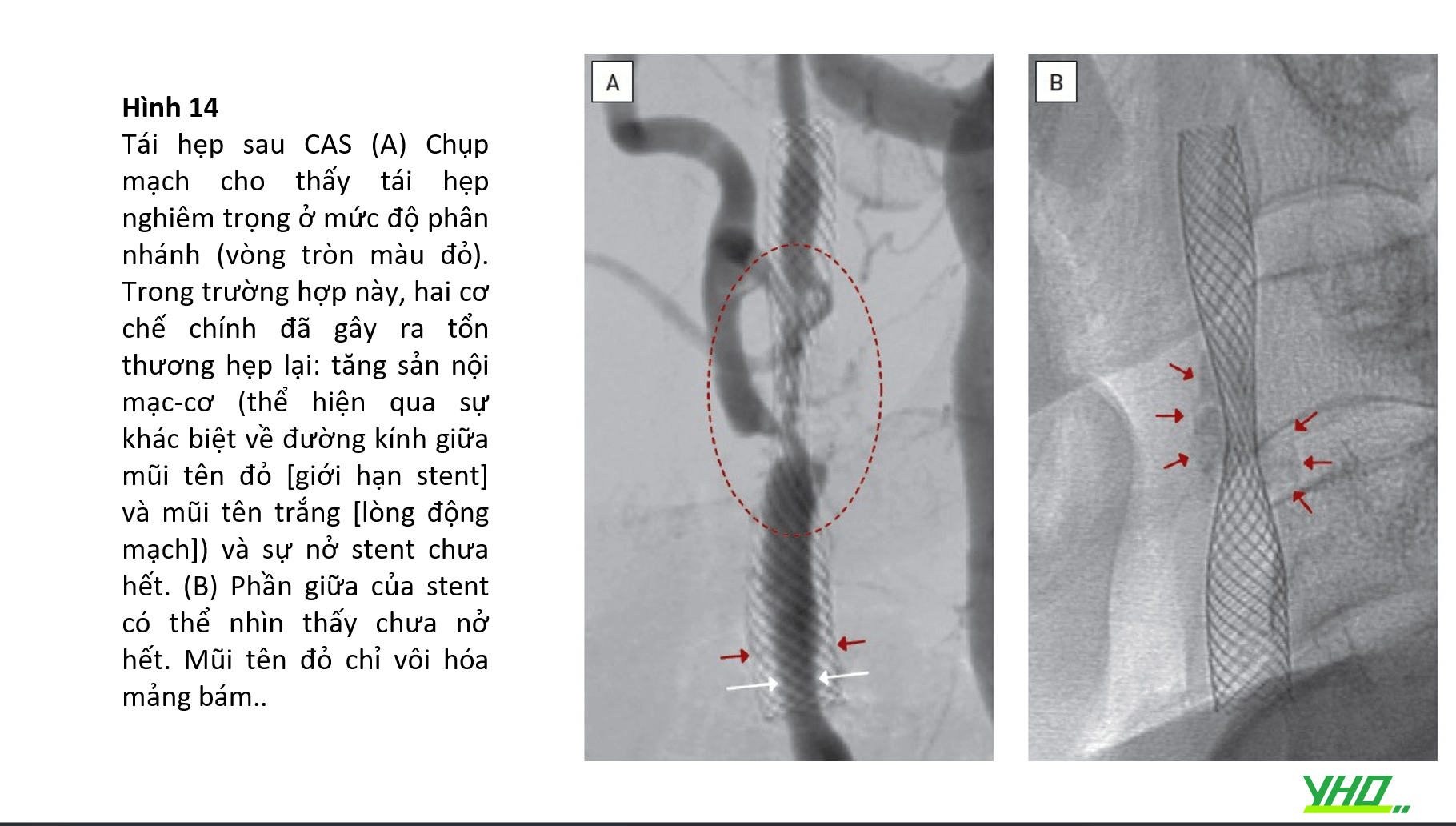
NONG TRƯỚC THẢ STENT
•Nong trước thả stent không phải là một bước bắt buộc khi thực hiện thủ thuật CAS, chỉ thực hiện với giải phẫu bị rất hẹp, có tổn thương vôi hóa nặng hoặc những chỗ hẹp có xu hướng tụt vào trong cao chẳng hạn như những tổn thương xơ hóa với mảng xơ vữa cao (Hình 14) . Thông thường, bóng nong mạch vành có đường kính từ 2,5 đến 3,5 mm và chiều dài từ 20 đến 30 mm được bơm căng ở áp suất danh định để giảm thiểu nguy cơ tắc mạch. Các tổn thương vôi hóa nặng nên được nong sơ bộ bằng bóng cắt mạch vành (có đường kính 3,5 – 4,0 mm) được bơm căng ở áp suất vừa phải (8 atm) (Hình 12D). Việc sử dụng bóng cắt đã được báo cáo trong giai đoạn tiền nong của quy trình CAS ở 178 bệnh nhân bị tổn thương mới bị vôi hóa cao nghiêm trọng với tỷ lệ thành công của quy trình là 99,4% 60. Tỷ lệ đột quỵ và tử vong kết hợp sau 30 ngày theo dõi là 0,6%, với một cơn đột quỵ.
Điều trị trước với 0,5-1 mg atropine tiêm tĩnh mạch có thể yêu cầu ở giai đoạn này để ngăn ngừa kích hoạt các chất dẫn truyền phế vị và nhịp tim chậm và/hoặc vô tâm thu sau đó (thường được sử dụng trong giai đoạn nong sau). Tránh dùng liều lượng lớn atropine cho người cao tuổi, vì có thể gây khó khăn cho việc đánh giá thần kinh chính xác.
NONG SAU THẢ STENT
•Nong sau thả stent là giai đoạn có nguy cơ thuyên tắc đoạn xa và vỡ động mạch cao nhất. Trong giai đoạn này, stent sẽ gây áp lực thụ động (bằng cách bơm phồng bóng) lên mảng xơ vữa động mạch cảnh và thành động mạch. Để giảm thiểu nguy cơ tắc mạch hoặc vỡ động mạch, những cân nhắc sau đây được khuyến cáo:
•Nên sử dụng bóng có đường kính không lớn hơn 5,5 mm.
•Bơm bóng nong mạch đến áp suất danh định.
•Chấp nhận mức độ hẹp tồn lưu <30% (theo tiêu chí Thử nghiệm cắt bỏ nội mạc động mạch cảnh có triệu chứng ở Bắc Mỹ [NASCET]).
•Thuốc cản quang tồn đọng xuyên qua các mắt cáo vào vết loét không cần phải nong rộng hơn nữa vì nó sẽ tự liền lại theo thời gian.
•Nếu ECA bị tắc trong khi thực hiện thủ thuật, thì chỉ nên cố gắng tái thông nếu bệnh nhân có triệu chứng (đau hàm hoặc mặt). Trong trường hợp như vậy, chỉ cần khôi phục dòng chảy TIMI II là đủ .
ĐÁNH GIÁ CUỐI CÙNG
•Sau khi rút EPD, cần chụp kiểm tra đánh giá. Khi sử dụng thiết bị bảo vệ đầu xa thì vùng đáp (landing zone) phải được kiểm tra cẩn thận để loại trừ tổn thương, co thắt hoặc bóc tách thành động mạch. Chụp động mạch nội sọ cùng bên nên được thực hiện thường xuyên và so sánh với chụp động mạch xóa nền để xác minh sự thông thoáng của tất cả các mạch. Theo cách này, thuốc cản quang đọng lại lâu dài trong mạch khi chụp mạch là dấu hiệu của tắc động mạch cấp tính.
QUẢN LÝ ĐƯỜNG VÀO
•Cần có tiêu chuẩn nhất định đánh giá đường vào. Có thể giúp bệnh nhân sớm đi lại bằng cách sử dụng các dụng cụ đóng mạch sau khi chụp mạch kiểm tra điểm đâm kim tại động mạch đùi chung và đảm bảo không có biến cố gì xảy ra trước khi đóng mạch.