Thuốc điều trị rối loạn lipid máu
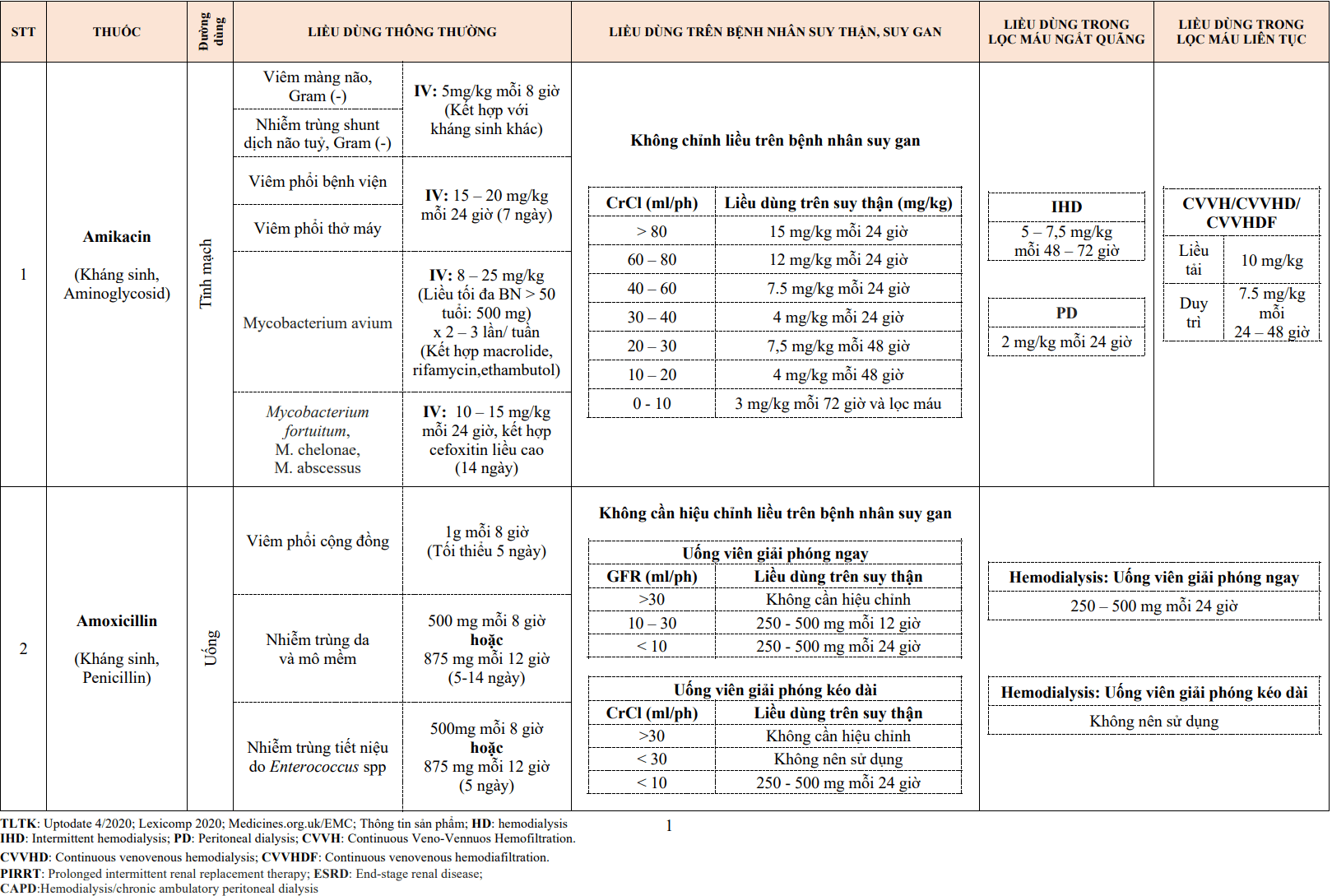
1. SINH LÝ BỆNH QUÁ TRÌNH XƠ VỮA ĐỘNG MẠCH
Xơ vữa động mạch là bệnh ở động mạch vừa và lớn. Bệnh được đặc trưng bởi tình trạng tích lũy dần các mảng lipid ở thành mạch, hậu quả là hẹp lòng mạch, giảm tưới máu ngoại vi. Mảng xơ vữa có thể gây hội chứng động mạch vành cấp khi có nứt vỡ mảng xơ vữa tại vị trí động mạch vành và kích hoạt hình thành cục máu đông.
Quá trình hình thành mảng xơ vữa được đặc trưng bởi:
- Tình trạng viêm thành mạch.
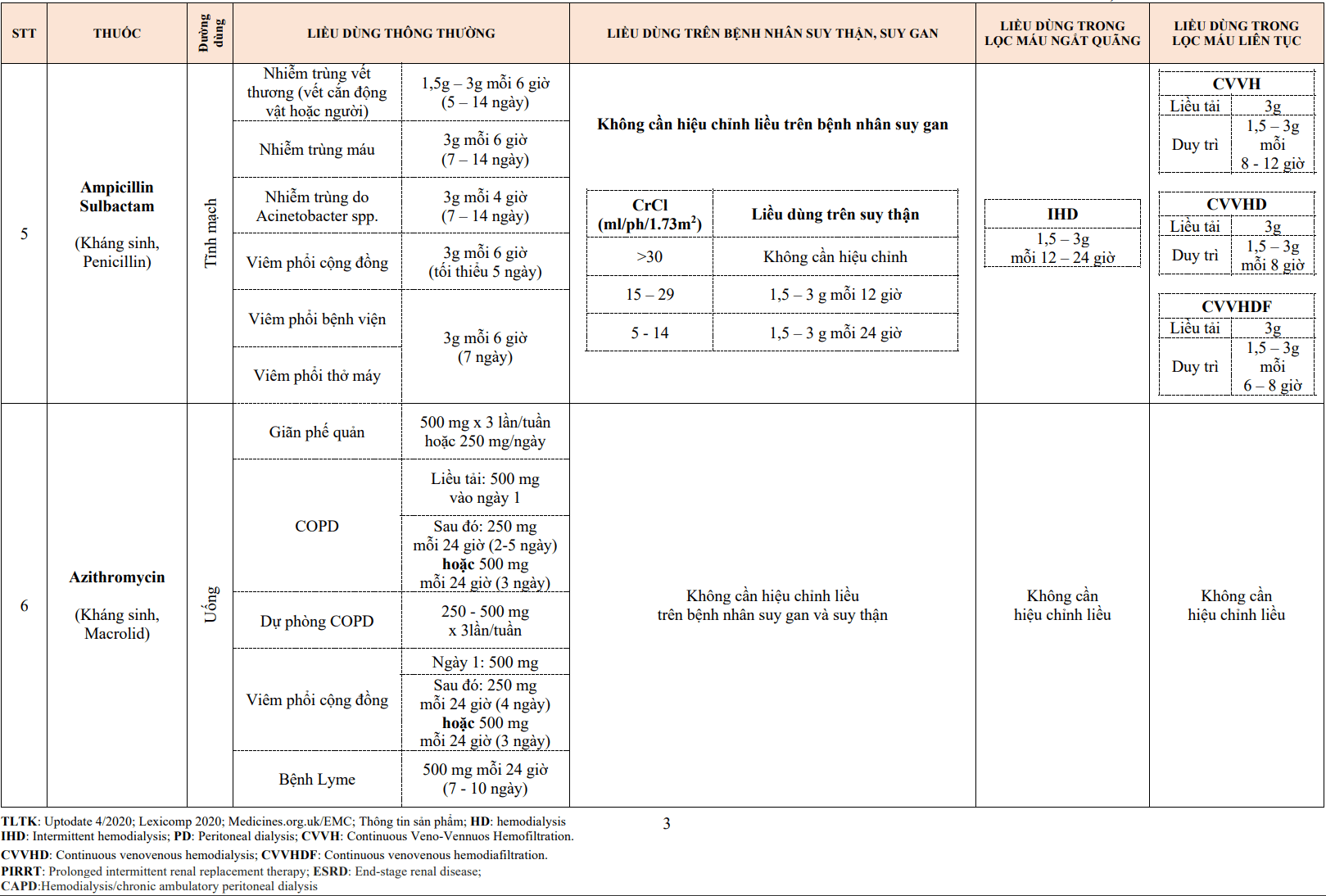
- Tích luỹ mảng lipid, cholesterol, các tế bào viêm ở thành mạch.
- Tích luỹ các mảnh xác tế bào ở lớp nội mạc và dưới nội mạc.
Các quá trình này cuối cùng hình thành mảng xơ vữa, gây rối loạn chức năng tế bào nội mạc và tái cấu trúc thành mạch. Cơ chế hình thành còn chưa rõ ràng nhưng giả thuyết được chấp nhận là giả thuyết “đáp ứng với tổn thương” của Ross vào những năm 1970.

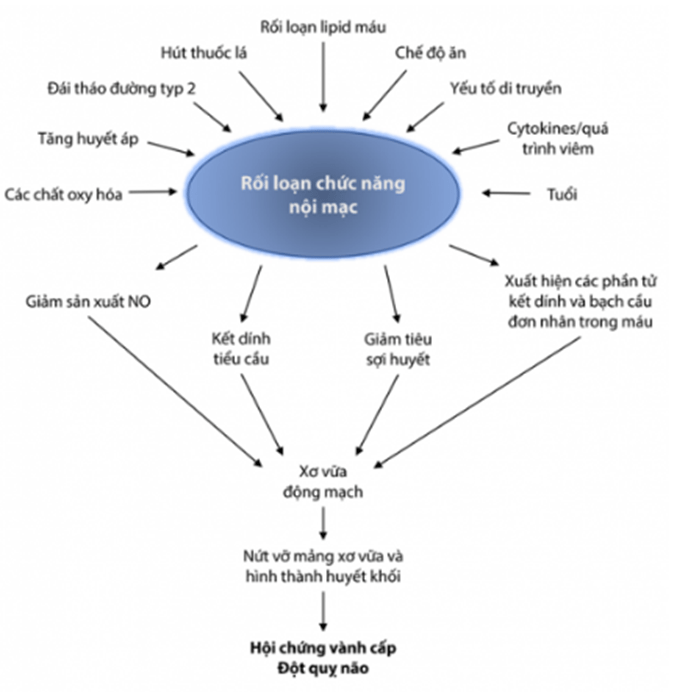
Hình 16.1 : Rối loạn chức năng nội mạc là cơ sở của quá trình hình thành mảng xơ vữa, các tổn thương ban đầu tiến triển dần và dẫn đến các biến cố mạch máu
Quá trình rối loạn chức năng tế bào nội mạc được kích hoạt bởi sự tổn thương lớp nội mạc mạch máu do sự tiếp xúc với các chất như: Các chất độc trong thuốc lá, LDL-C bị oxy hoá, các sản phẩm cuối cùng của quá trình đường phân, tăng homocysteine và các tác nhân nhiễm trùng.
Tế bào nội mô bắt đầu tổn thương dẫn tới mất cân bằng trong sản xuất các chất gây giãn mạch từ tế bào nội mô:
- Giảm hoạt tính sinh học của NO, một chất giãn mạch quan trọng, chống huyết khối, chống tăng sinh.
- Tăng sinh các chất co mạch: Endothelin-1 và angiotensin-II, hoạt hoá quá trình di cư và tăng sinh tế bào.
- Mất chức năng tế bào nội mô, xuất hiện các chất kết dính và các chất hoá ứng động làm di cư và tăng sinh tế bào.
- Mất cân bằng quá trình đông-cầm máu tại chỗ như thay đổi chất ức chế hoạt hóa plasminogen và các yếu tố mô được tăng tiết.
- Yếu tố hoạt hóa plasminogen (t-PA) thrombomodulin bị giảm đi.
- Giảm sản xuất NO làm tăng hoạt hoá và kết dính tiểu cầu.
Rối loạn chức năng nội mạc dẫn đến hình thành vi môi trường với sự phát triển mảng xơ vữa:
- Bạch cầu trong máu, chủ yếu là bạch cầu đơn nhân được gắn và hoạt hoá tế bào nội mô, sau đó di cư tới lớp dưới nội mô và chuyển thành các đại thực bào. Chúng hấp thu LDL-C đến khi chứa đầy lipid và trở thành các tế bào bọt.
- Các tổn thương sớm được gọi là các vệt mỡ, chủ yếu chứa các đại thực bào rất giàu lipid và các tế bào bọt.
- Các tổn thương này phát triển thành mảng xơ khi hình thành và tích luỹ các tế bào cơ trơn bị chuyển thành tế bào sợi. Các tế bào này chịu trách nhiệm chính trong việc lắng đọng chất nền ngoại bào dẫn tới hình thành vỏ xơ bao phủ một lõi chứa đầy lipid, tế bào bọt, tế bào hoại tử pha lẫn với các tế bào viêm gồm cả các tế bào lympho T.
- Các quá trình này hoạt hoá sự rối loạn chức năng tế bào nội mô, cùng với các chất gây tăng sinh mạnh như yếu tố phát triển nguồn gốc tiểu cầu (PDGF), yếu tố tăng trưởng chuyển dạng beta (TGF-β) và yếu tố tăng sinh giống insulin (IGF) từ các tế bào nội mạc, đại thực bào, tiểu cầu được hoạt hoá.
- Mảng xơ vữa ngày càng phát triển và bắt đầu gây tái cấu trúc thành mạch, ảnh hưởng tới diện tích lòng mạch và khả năng dẫn máu.
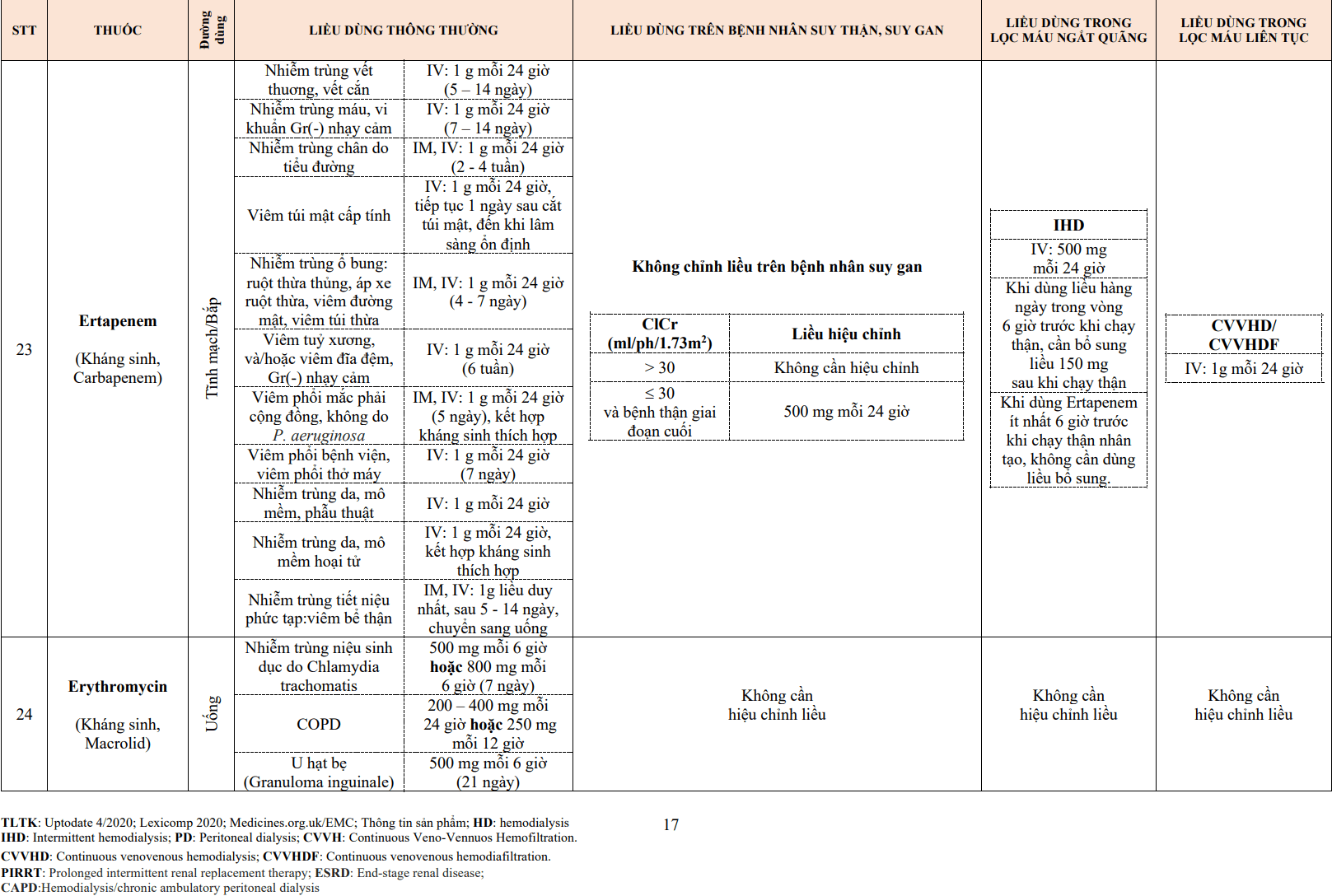
- Mảng xơ vữa ngày càng lớn, tích luỹ ngày càng nhiều và hậu quả là hẹp lòng mạch, cuối cùng có thể gây tắc mạch.
Tổn thương hình thành và phát triển có xu hướng rõ ràng hơn ở những vị trí mạch máu nhất định. Dòng máu chảy gây ra áp lực trên thành mạch, nó ảnh hưởng đến đặc tính sinh học của tế bào nội mô. Khi áp lực càng lớn trên thành mạch thẳng, tế bào nội mô càng tiết ra nhiều NO gây giãn mạch để cân bằng khả năng dẫn máu. Ở đoạn mạch với áp lực thay đổi – nhất là ở đoạn gập góc, có dòng máu xoáy gây ra rối loạn chức năng nội mạc, chúng kích hoạt quá trình hình thành mảng xơ vữa. Điều này giúp giải thích tại sao mảng xơ vữa lại hay gặp ở đoạn mạch chia nhánh hoặc gập góc. Ảnh hưởng của áp lực dòng máu thường thấy rõ nhất ở mạch có tốc độ dòng máu cao như mạch não, mạch vành, mạch thận, mạch chậu.
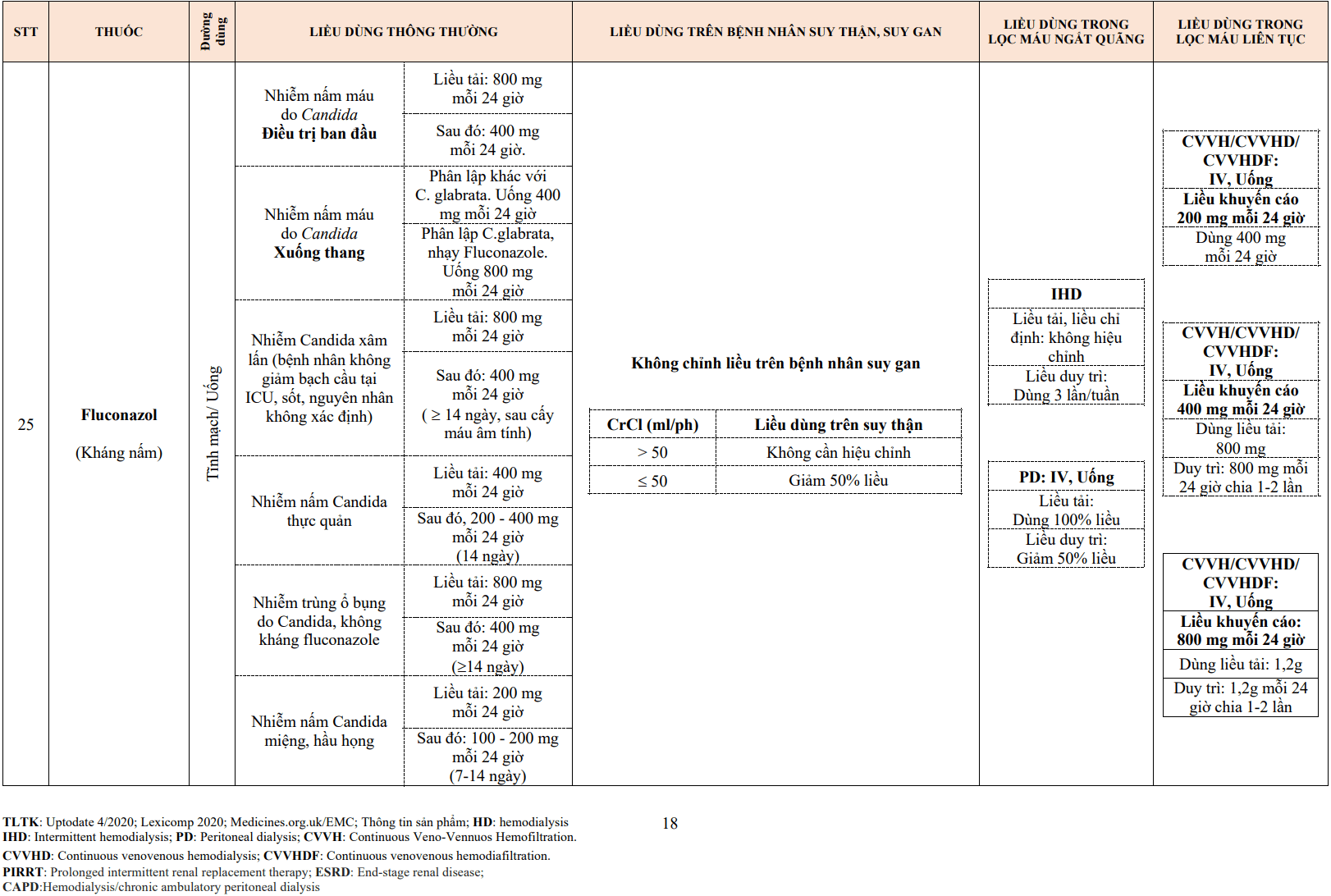
2. BẰNG CHỨNG THUỐC ĐIỀU TRỊ RỐI LOẠN LIPID TRÊN LÂM SÀNG
2.1. Bằng chứng lâm sàng của điều trị rối loạn lipid máu phòng ngừa nguyên phát của bệnh tim mạch
Các bằng chứng mạnh mẽ từ các thử nghiệm ngẫu nhiên đã đánh giá tác động của việc giảm LDL-C ( thay thế cho việc điều trị giảm cholesterol toàn phần theo các điều trị trước đây) đã chứng minh giảm các biến cố bệnh tim mạch, bất kể mức độ LDL-C trước điều trị. Trong số các biến cố này, biến cố nhồi máu cơ tim được giảm nhiều nhất.
Ba thử nghiệm đầu tiên của liệu pháp điều trị rối loạn lipid máu dựa trên các nhóm thuốc fibrate, cholestyramine hoặc gemfibrozil. Việc điều trị bằng các thuốc này không tìm thấy sự khác biệt về tỷ lệ tử vong do bệnh mạch vành và thậm chí có sự gia tăng tỷ lệ tử vong do bệnh tim mạch (ngoại trừ cholestyramine). Trái ngược với kết quả đó, nhiều thử nghiệm ngẫu nhiên lớn về điều trị statin đã chứng minh giảm được tình trạng nhồi máu cơ tim và tử vong do tim mạch. Sau đây là những nghiên cứu tiêu biểu:
Nghiên cứu phòng ngừa bệnh mạch vành ở phía tây Scotland (WOSCOPS) cho thấy giảm cholesterol bằng pravastatin (40 mg/24h) trong 5 năm làm giảm cả số ca nhồi máu cơ tim không tử vong và bệnh mạch vành (CHD) ở nam giới trung niên có mức LDL trên 155 mg/dL (4,0 mmol/L). LDL-C đã giảm 26% từ 192 xuống còn 142 mg/dL (5,0 xuống 3,7 mmol/L) qua đó giảm 22% tỷ lệ tử vong do mọi nguyên nhân. Theo dõi kéo dài kết quả kiểm tra thử nghiệm 10, 15 và 20 năm sau khi kết thúc thử nghiệm cho thấy tiếp tục giảm tỷ lệ tử vong ở những bệnh nhân ban đầu được chỉ định dùng thuốc pravastatin.
Thử nghiệm JUPITER với việc sử dụng rosuvastatin 20 mg/24h ở nam giới và phụ nữ trưởng thành khỏe mạnh có protein phản ứng C ≥2 mg/L và LDL-C dưới 130 mg/dL (3,4 mmol/L) cho thấy giảm rõ rệt các biến cố chính các sự kiện tim mạch lớn và tử vong do mọi nguyên nhân (HR = 0,56 và 0,80, tương ứng). Lợi ích tuyệt đối giảm là 0,59 biến cố chính trên 100 người và tỷ lệ tử vong do mọi nguyên nhân là 0,25 trường hợp tử vong trên 100 người. Trong JUPITER, mức LDL – C cuối cùng là 55 mg/dL (1,4 mmol/L) trong nhóm rosuvastatin và 110 mg/dL (2,8 mmol/L) trong nhóm giả dược. Thử nghiệm này đã được dừng lại sớm vì lợi ích vượt trội rõ ràng của rosuvastatin.
Trong thử nghiệm HOPE-3, 12.705 bệnh nhân có ít nhất một yếu tố nguy cơ bệnh lý tim mạch được chỉ định ngẫu nhiên cho rosuvastatin 10 mg hoặc giả dược hằng ngày. Mức LDL-C trung bình là 128 mg/dL (3,3 mmol/L). Mức LDL-C được duy trì thấp hơn 39,6 mg/dL (1,02 mmol/L) trong nhóm rosuvastatin. Kết cục tổng hợp ban đầu (tử vong do bệnh lý tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong) có tỷ lệ giảm rõ rệt với nhóm điều trị bằng statin (3,7% so với 4,8%; HR = 0,76, 95%CI 0,64-0,91).
Nhiều phân tích gộp các thử nghiệm lâm sàng về điều trị hạ LDL-C ở bệnh nhân có và không có bệnh lý tim mạch đã được thực hiện và các tác giả đã tìm thấy bằng chứng mạnh mẽ về việc giảm bệnh lý tim mạch và tử vong do nguyên nhân tim mạch. Các phân tích gộp khác cũng cho thấy statin giảm nguy cơ tử vong do mọi nguyên nhân.
Một phân tích gộp năm 2016 đã đánh giá kết quả ở hơn 300.000 cá nhân với nhiều yếu tố nguy cơ trong 49 thử nghiệm. Mức LDL-C trung bình là 122 mg/dL (3,16 mmol/L). Kết quả cho thấy:
- Nguy cơ tương đối của các biến cố mạch máu lớn (tổng hợp tử vong do tim mạch, hội chứng động mạch vành cấp tính, tái thông mạch vành hoặc đột quỵ tắc mạch não) mỗi lần giảm 38,7 mg/dL (1 mmol/L) trong LDL-C là 0,77 (95 % CI 0,71-0,84) cho statin và 0,75 (95% CI 0,66-0,86) cho các liệu pháp không dùng statin.
- Trong số 8 thử nghiệm phòng ngừa tiên phát, LDL-C sau điều trị có tương quan tuyến tính với các biến cố tim mạch, trị số LDL-C sau điều trị thấp hơn có tỷ lệ biến cố thấp hơn và mức LDL-C sau điều trị cao hơn có biến cố cao hơn.
Các phân tích tổng hợp đầy đủ nhất về các thử nghiệm phòng ngừa tiên phát cho thấy statin giảm tỷ lệ tử vong do mọi nguyên nhân (nguy cơ tương đối 0,91). Mức giảm tương đối này được chuyển thành mức giảm tuyệt đối về tử vong 0,09% mỗi năm (1,33 so với 1,42% mỗi năm).
Qua kết quả của các nghiên cứu cho thấy giảm LDL-C bằng liệu pháp statin để phòng ngừa tiên phát rất có hiệu quả trong việc giảm các biến cố tim mạch (chủ yếu là nhồi máu cơ tim) trên một loạt các mức LDL-C cơ bản và giảm nguy cơ tương đối tương tự điều trị bằng statin trong dự phòng thứ phát nhưng giảm tuyệt đối thấp hơn.
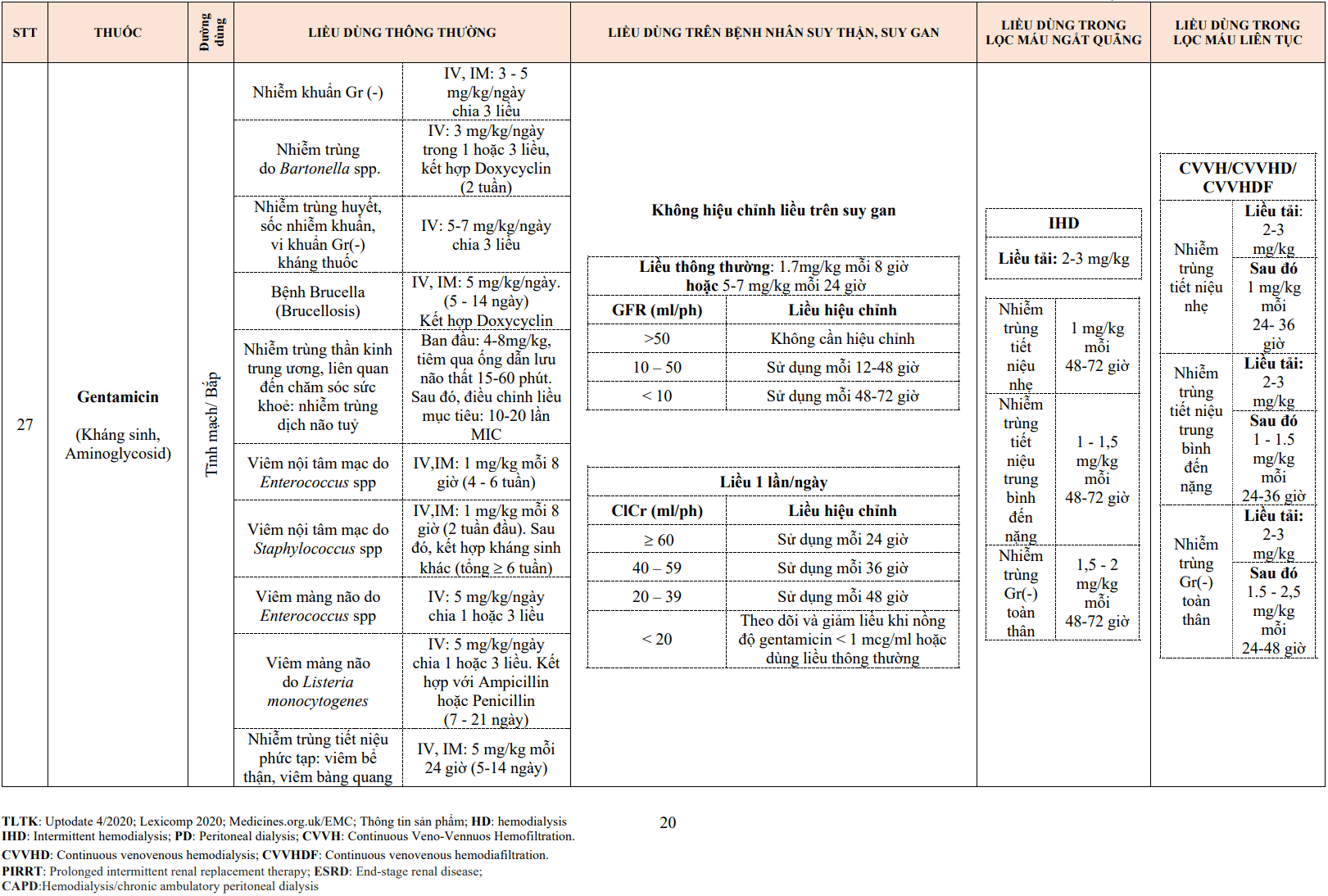
2.2. Bằng chứng lâm sàng của điều trị rối loạn lipid máu phòng ngừa thứ phát bệnh tim mạch
Trên các bệnh nhân có bệnh tim mạch (CVD) và bất kể mức LDL-C ban đầu, hầu hết các phương pháp điều trị làm giảm LDL-C đều giúp làm giảm nguy cơ nhồi máu cơ tim (MI) và thiếu máu cơ tim cục bộ.
Việc giảm tỷ lệ tử vong trong điều trị rối loạn lipid máu phụ thuộc vào mức nguy cơ tim mạch của bệnh nhân và mức LDL-C ban đầu. Một phân tích tổng hợp năm 2018 của 34 thử nghiệm ngẫu nhiên (n = 270.788) đánh giá hiệu quả của việc phòng ngừa thứ phát của việc hạ nồng độ LDL-C. Trong đó tỷ lệ tử vong do mọi nguyên nhân thấp hơn (RR = 0,92, 95%CI 0,88-0,96) ở nhóm hạ LDL-C tích cực nhưng thay đổi theo mức LDL-C ban đầu. Việc giảm LDL-C mạnh hơn dẫn đến nguy cơ tử vong do mọi nguyên nhân thấp hơn đáng kể trên các bệnh nhân có mức LDL-C ban đầu lớn hơn 100 mg/dL (p < 0,001).
Một phân tích tổng hợp năm 2011 các thử nghiệm ngẫu nhiên đánh giá hiệu quả của liệu pháp statin trên các bệnh nhân mắc hội chứng động mạch vành mạn và hội chứng động mạch vành cấp (n = 41.778) cho thấy điều trị hạ LDL-C tích cực làm giảm nguy cơ mắc nhồi máu cơ tim không tử vong (RR 0,82; 95% CI 0,76 – 0,89).
Ezetimibe được đánh giá trong thử nghiệm IMPROVE-IT trên 18.144 bệnh nhân mắc hội chứng động mạch vành cấp trong 10 ngày trước đó và LDL-C từ 50 đến 100 mg/dL (1,3 đến 2,6 mmol/L) nếu điều trị hạ lipid máu hoặc LDL-C từ 50 đến 125 mg/dL (1,3 đến 3,2 mmol/L) nếu không điều trị hạ lipid máu. Bệnh nhân được chỉ định ngẫu nhiên cho simvastatin 40 mg/24h cộng với ezetimibe 10 mg/24h hoặc simvastatin 40 mg/24h cộng với giả dược. LDL-C trung bình theo thời gian trung bình đạt được thấp hơn ở nhánh ezetimibe/simvastatin (53,7 so với 69,5 mg/dL [1,4 so với 1,8 mmol/L]). Sau sáu năm theo dõi trung bình, đã có sự giảm nguyên phát (tử vong do tim mạch, nhồi máu cơ tim, đau thắt ngực không ổn định cần nhập viện ) ở nhánh ezetimibe/simvastatin (HR 0,94, CI 0,89-0,99). Điều này dẫn đến việc giảm tuyệt đối tỷ lệ kết cục chính trong bảy năm (32,7 so với 34,7%). Không có giảm tỷ lệ tử vong do mọi nguyên nhân (HR 0,99, CI 0,91-1,07) hoặc tử vong do tim mạch (HR 1,00, CI 0,89-1,13); tuy nhiên, NMCT (HR 0,87, CI 0,80-0,95) và đột quỵ (HR 0,86, CI 0,73-1,00) đã giảm.
Liên quan đến liệu pháp bổ sung trên liệu pháp statin
Thử nghiệm FOURIER cho thấy vai trò của thuốc ức chế PSCK9 với evolocumab trên nền tảng của liệu pháp statin trong việc giảm các biến cố tim mạch ở bệnh nhân mắc bệnh tim mạch xơ vữa động mạch khi giảm mức LDL-C dưới mức mục tiêu hiện tại. Sau 48 tuần, evolocumab làm giảm 59% LDL-C, từ giá trị cơ bản trung bình là 2,4 mmo/L xuống 0,78 mmoL/L (p < 0,001). So với giả dược, điều trị bằng evolocumab làm giảm đáng kể nguy cơ của biến cố chính (9,8% so với 11,3%) (HR = 0,85; 95%CI 0,79 – 0,92; p < 0,001) và các tiêu chí phụ (5,9% so với 7,4%; HR = 0,80; 95%CI 0,73 – 0,88; p < 0,001). Các kết quả phù hợp giữa các nhóm nhỏ chính, bao gồm cả nhóm bệnh nhân trong nhóm thấp nhất về mức cholesterol LDL cơ bản (trung bình 1,9 mmol/L).
Nhiều chuyên gia giải thích các bằng chứng được trình bày ở trên là ủng hộ quan niệm rằng hạ LDL-C thấp là tốt hơn, rằng việc giảm các sự kiện mạch máu lớn tỷ lệ thuận với việc giảm LDL-C tuyệt đối và mọi cố gắng hợp lý nên được thực hiện để giảm đáng kể LDL-C.
Liên quan đến việc đưa ra các khuyến nghị cho mục tiêu điều trị, chúng tôi giải thích rộng rãi các bằng chứng như sau:
- Bệnh nhân có nguy cơ cao được giảm nguy cơ tuyệt đối lớn hơn khi điều trị so với bệnh nhân có nguy cơ thấp hơn.
- Liệu pháp hạ lipid càng mạnh trong việc giảm LDL-C, giảm nguy cơ tương đối CVD càng lớn.
Mặc dù bằng chứng không xác định rõ ràng ngưỡng dưới mức giảm LDL-C hơn nữa dẫn đến ít lợi ích, các tác giả cho rằng những nỗ lực hạ LDL-C <70 mg/dL (1,8 mmol/L) nên được thực hiện ở hầu hết bệnh nhân với CVD. Trên những bệnh nhân có nguy cơ cao và rất cao có thể được cân nhắc ngưỡng LDL-C thấp hơn. Không có nghiên cứu nào đánh giá 70 mg/dL (1,8 mmol/L) là mục tiêu điều trị. Giá trị này đã được các chuyên gia đồng thuận chấp nhận như là một mục tiêu hợp lý dựa trên nhiều nghiên cứu về việc hạ LDL-C.
Tất cả các thử nghiệm điều trị hạ LDL-C đã chứng minh kết quả tốt hơn ở nhóm đã nhận được giảm LDL-C tích cực hơn (cho dù so sánh là giả dược hay liệu pháp statin liều thấp). Nhiều thử nghiệm đã đạt được mức LDL-C dưới 70 mg/dL (1,8 mmol/L). Điều này đúng với statin liều cao (JUPITER), statin cộng với ezetimibe (IMPROVE-IT) và thuốc ức chế PCSK9 (FOURIER). Các liệu pháp statin liều cao đã được sử dụng trong các thử nghiệm quan trọng như TNT, SATURN, JUPITER.
Hầu hết các phân tích đã đề xuất lợi ích liên tục của việc hạ LDL-C. Trong một phân tích tổng hợp năm 2010 của 26 thử nghiệm (gần 170.000 bệnh nhân) điều trị bằng statin ở nhiều bệnh nhân và mức LDL-C cơ bản, đã giảm khoảng 22% tỷ lệ các biến cố mạch máu chính trên 40 mg/dL ( 1,0 mmol/L) giảm LDL-C.
Cuối cùng, việc sử dụng hai nhóm thuốc hạ LDL-C ở bệnh nhân điều trị bằng statin đã được chứng minh là dẫn đến giảm thêm các sự kiện CVD trong các quần thể nghiên cứu đạt LDL-C trung bình dưới 55 mg/dL:
- Trong thử nghiệm FOURIER (chất ức chế PCSK9): bắt đầu LDL-C là 90 mg/dL; LDL-C cuối cùng là 30 mg/dL.
- Trong thử nghiệm IMPRISE IT (ezetimibe ): bắt đầu LDL-C là 69 mg/dL; LDL-C cuối cùng là 54 mg/dL.
3. THUỐC ĐIỀU TRỊ RỐI LOẠN LIPID MÁU TRONG MỘT SỐ TRƯỜNG HỢP CỤ THỂ
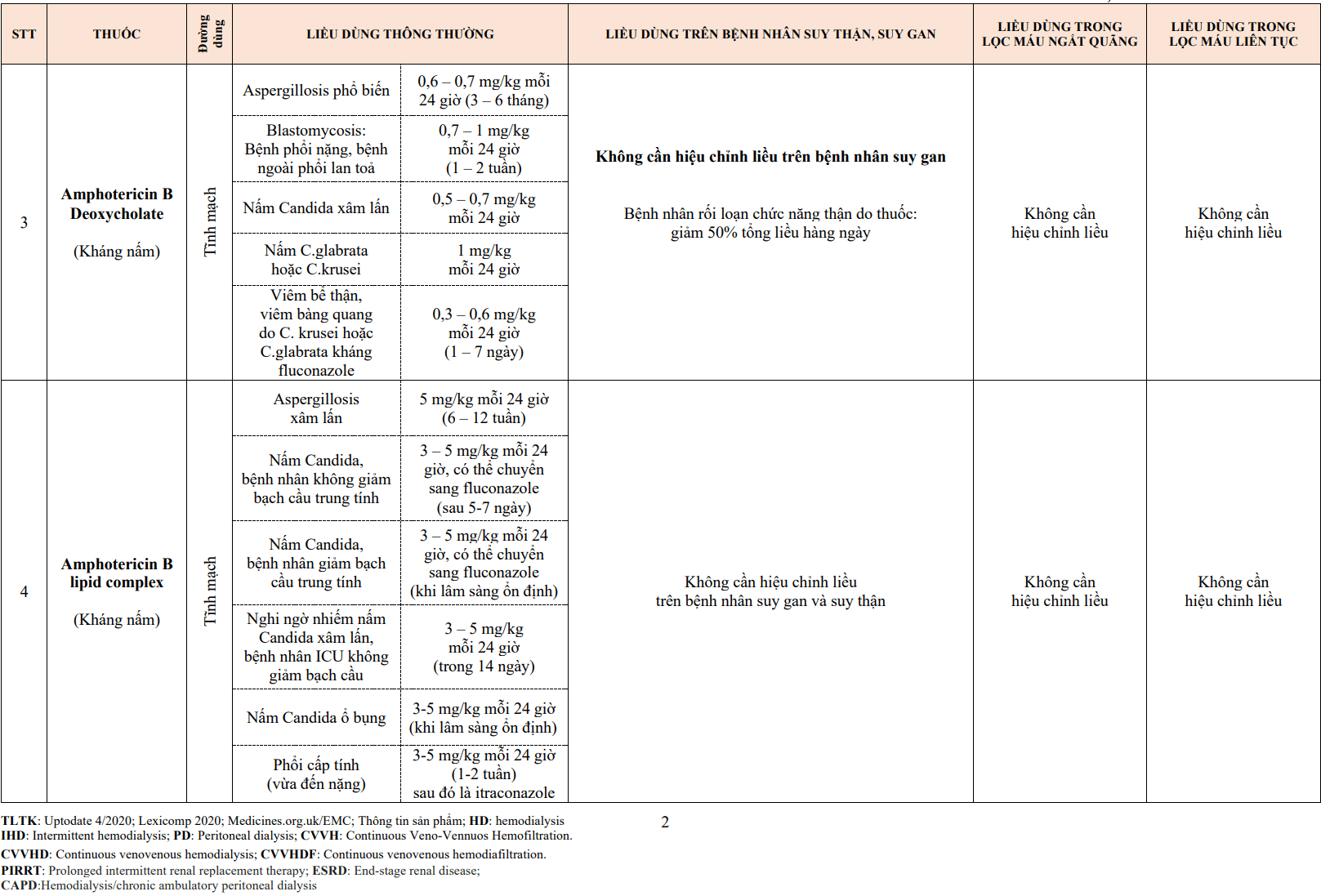
3.1.Thuốc điều trị tăng triglyceride máu
- Nồng độ TG tăng cao có liên quan độc lập với nguy cơ mắc bệnh tim mạch do xơ vữa động mạch (ASCVD), đặc biệt là nguy cơ mắc bệnh tim mạch vành. Tuy nhiên, quan hệ nhân quả chưa được thiết lập.
- Tất cả các bệnh nhân bị tăng triglyceride máu cần thay đổi lối sống bao gồm thay đổi chế độ ăn, tập thể dục, bỏ thuốc lá. Cần kiểm soát đường huyết ở bệnh nhân đái tháo đường và giảm cân với bệnh nhân béo phì.
- Không có đích cụ thể trong điều trị tăng TG máu nhưng giảm TG < 1,7 mmol/L (<150 mg/dL) giúp giảm các biến cố tim mạch.
- 1,7 mmol/L < TG < 10mmol/L: Xem xét dùng statin khi mà TG không thể được hạ xuống bằng các biện pháp lối sống.
- TG > 10 mmol/L: Cần điều trị bằng thuốc để hạ thấp nguy cơ viêm tụy cấp.
- Fibrate hiện nay có fenofibrate, gemfibrozil, bezafibrate. Fibrate có thể làm giảm nồng độ TG tới 50% hoặc hơn.
- Fenofibrate là fibrat phổ biến nhất, được chỉ định dưới dạng công thức nano tinh thể (145 mg/ngày, uống vào bất kỳ thời điểm nào trong ngày), dạng viên nang micronized (200 mg/ngày, uống trong bữa tối) hoặc dưới dạng acid fenofibric (còn được gọi là choline fenofibrate; 145 mg mỗi ngày). Giảm 1/2 liều khi MLCT: 30-59 mL/phút. Không nên sử dụng khi MLCT < 30 mL/phút.
- Gemfibrozil được kê đơn với liều 600 mg hai lần mỗi ngày và được dùng trước bữa sáng và bữa tối. Gemfibrozil có thể gây tăng aminotransferase huyết thanh nhẹ, tăng nguy cơ tiêu cơ vân cấp khi sử dụng cùng statin.
- Bezafibrate được kê đơn với liều 200 mg ba lần mỗi ngày hoặc liều duy trì giải phóng hằng ngày 400 mg mỗi ngày.
- Acid béo Omega-3: Có 3 chế phẩm omega-3-acid ethyl esters (Lovaza), eicosapentaenoic và acid docosahexaenoic (EPA/DHA) và icosapent ethyl (Vascepa) là một ethyl ester của EPA liều 4 g/ngày. Acid béo Omega-3 làm giảm 27 – 45 % TG máu đói. Acid béo Omega – 3 có thể làm tăng LDL- C, trong quá trình điều trị cần theo dõi AST, ALT trên bệnh nhân suy gan. Có thể làm tăng tần số triệu chứng trên bệnh nhân rung nhĩ cơ hoặc rung nhĩ dai dẳng trong 2 đến 3 tháng đầu điều trị.
- Niacin có thể giúp giảm 20-30% nồng độ TG. Niacin được chỉ định trong tăng trigliceride khi mức triglyceride trong máu tăng cao > 10 mmol/L hoặc không dung nạp hay đáp ứng với nhóm fibrate. Liều thông thường 250 mg/ngày. Niacin có thể gây ra các triệu chứng đường tiêu hóa, độc với gan, rung nhĩ, tăng nguy cơ chảy máu khi kết hợp với aspirin và tăng nồng độ acid uric dẫn đến Gout thứ phát.
3.2. Thuốc điều trị tăng cholesterol máu gia đình
Bệnh tăng cholesterol máu gia đình (Familial Hypercholesterolemia – FH) là bệnh lý di truyền gen trội trên nhiễm sắc thể thường, đặc trưng bởi hiện tượng nồng độ LDL-C huyết tương tăng cao, các mảng xơ vữa mạch máu xuất hiện sớm gây ra bệnh động mạch vành, đột quỵ não. Tỷ lệ lưu hành của bệnh FH trong cộng đồng là 1/500 – 1/200 với ước tính khoảng 20 triệu người mắc trên thế giới.
a. Mục tiêu điều trị
- Bệnh nhân FH không có bệnh mạch máu do xơ vữa (bệnh mạch vành, đột quỵ, bệnh động mạch ngoại vi), không có yếu tố nguy cơ tim mạch nghiêm trọng, mức LDL-C cần giảm ≥ 50% so với giá trị ban đầu và đích LDL-C < 1,8 mmol/L.
- Bệnh nhân FH có bệnh mạch máu do xơ vữa (bệnh mạch vành, đột quỵ, bệnh động mạch ngoại vi) hoặc có yếu tố nguy cơ tim mạch nghiêm trọng, mức LDL-C cần giảm ≥ 50% so với giá trị ban đầu và đích LDL-C < 1,4 mmol/L.
- Bệnh nhân FH có bệnh mạch máu do xơ vữa (bệnh mạch vành, đột quỵ, bệnh động mạch ngoại vi) với biến cố tim mạch tái phát lần 2 trong vòng 2 năm gần đây mà đã dùng statin liều cao nhất có thể dung nạp được thì mức LDL-C cần điều trị giảm xuống < 1,0 mmol/L.
- Với trẻ 8 – 10 tuổi, mức LDL-C cần giảm ≥ 50% so với giá trị ban đầu. Trong khi với trẻ > 10 tuổi, mức LDL-C cần đạt < 3,5 mmol/L.
b. Điều chỉnh lối sống, loại bỏ các yếu tố nguy cơ tim mạch (ESC 2019)
Thay đổi lối sống và kiểm soát các yếu tố nguy cơ tim mạch cần được thực hiện ngay khi chẩn đoán FH, bao gồm:
- Bỏ thuốc lá.
- Chế độ ăn kiêng, giảm tiêu thụ lượng chất béo bão hòa, tăng khẩu phần hoa quả, rau, hạt còn lớp áo vỏ, hạnh nhân, các chế phẩm sữa ít hoặc không chứa chất béo, các loại đậu, cá.
- Tăng hoạt động thể lực: Trung bình duy trì 3,5 – 7h hoạt động thể lực mỗi tuần hoặc 30 – 60 phút mỗi ngày.
- Kiểm soát cân nặng, vòng bụng: BMI duy trì 20 – 25 kg/m2, vòng bụng < 94 cm (nam) và < 80 cm (nữ).
- Kiểm soát chỉ số huyết áp < 140/90 mmHg.
- Kiểm soát chỉ số HbA1c < 7%.
c. Điều trị hạ LDL-C
- Statin cường độ mạnh: Cần được thực hiện sớm nhất và duy trì đều đặn ở bệnh nhân FH, ưu tiên lựa chọn statin mạnh như rosuvastatin, atorvastatin. Đa số bệnh nhân cần duy trì statin mạnh ở liều cao nhất mà có thể dung nạp. Trẻ em mắc FH có thể cần sử dụng statin từ 8 – 10 tuổi, với khởi đầu ở liều thấp và tăng dần liều cho ngưỡng tối đa có thể dung nạp để đạt mục tiêu LDL-C.
- Ezetimibe: Có thể dùng phối hợp với statin để đạt LDL-C mục tiêu. Liều ezetimibe 10 mg/24h phối hợp với statin giúp giảm thêm 10 – 20% mức LDL-C.
- Thuốc ức chế PCSK9: Nên được dùng cho bệnh nhân thể đồng hợp tử hoặc thể dị hợp tử có biến cố tim mạch nếu không đạt được đích LDL-C sau khi điều trị bằng statin liều tối đa > 6 tháng hoặc không dung nạp với statin. Thuốc ức chế PCSK9 có thể làm giảm tới 50 – 70% mức LDL-C ở các bệnh nhân FH. Điều trị hạ LDL-C bằng thuốc ức chế PCSK9 có hiệu quả với FH có đột biến gen tăng hoạt động của PCSK9.
- Lomitapide: Được FDA chấp thuận sử dụng cho bệnh nhân FH thể đồng hợp tử ≥ 18 tuổi.
- Mipomersen: Được FDA chấp thuận sử dụng cho bệnh nhân FH thể đồng hợp tử ≥ 12 tuổi.
- Lọc máu đặc hiệu cho LDL-C: Giúp cải thiện kết cục tử vong và giảm biến cố tim mạch cho bệnh nhân FH. Lọc máu đặc hiệu cho LDL-C nên được dùng cho bệnh nhân thể đồng hợp tử nếu không đạt được đích LDL-C sau khi điều trị bằng statin liều tối đa > 6 tháng hoặc không dung nạp với statin. Phương pháp này có thể được chỉ định ở phụ nữ có thai.
- Trao đổi huyết tương: Có thể xem xét chỉ định cho bệnh nhân FH thể đồng hợp tử khi không có lọc máu đặc hiệu cho LDL-C và thuốc ức chế PCSK9.
- Tạo shunt tĩnh mạch cửa – tĩnh mạch chủ dưới: Hiệu quả cho bệnh nhân FH thể đồng hợp tử ở nơi không thể thực hiện được lọc máu đặc hiệu cho LDL-C.
- Ghép gan: Hiệu quả cho bệnh nhân FH thể đồng hợp tử ở nơi không thể thực hiện được lọc máu đặc hiệu cho LDL-C.
3.3. Thuốc điều trị rối loạn lipid ở bệnh nhân cao tuổi
- Người già được định nghĩa là những người trên 65 tuổi. Tuổi thọ con người càng ngày càng tăng, dân số lão hoá, do đó tỷ lệ người già trong xã hội gia tăng. Theo thống kê, trên 80% số người chết vì các bệnh lý tim mạch (CVD) là trên 65 tuổi. Tỷ lệ bệnh nhân bị nhồi máu cơ tim cấp trên 85 tuổi đã tăng gấp nhiều lần. Các phân tích tổng hợp đã chỉ ra rằng tổng lượng cholesterol cao có liên quan đến tỷ lệ tử vong do CAD tăng ở mọi lứa tuổi.
- Các nghiên cứu đánh giá vai trò dự phòng tiên phát của statin trên người cao tuổi cho thấy, statin giúp giảm tỷ lệ các biến cố tim mạch và tỷ lệ tử vong chung. PROSPER là một thử nghiệm mang tính bước ngoặt đánh giá 5804 bệnh nhân 70 – 82 tuổi dùng pravastatin 40 mg/ngày hoặc giả dược. Thử nghiệm này đã chứng minh pravastatin làm giảm 15% nguy cơ tương đối bao gồm tử vong tim mạch, nhồi máu cơ tim không tử vong và đột quỵ gây tử vong hoặc không tử vong trong thời gian 3,2 năm.
- Vai trò của statin trong dự phòng thứ phát ở người cao tuổi được khái quát qua một phân tích tổng hợp gồm 9 thử nghiệm bao gồm 19.569 bệnh nhân với độ tuổi từ 65 đến 82 tuổi. Tỷ lệ tử vong do mọi nguyên nhân là 15,6% với statin và 18,7% với giả dược. Mức giảm nguy cơ tương đối là 22% trong 5 năm (RR = 0,78; 95%CI 0,65 – 0,89). Hơn nữa, statin làm giảm 30% tỷ lệ tử vong do bệnh mạch vành (RR = 0,70; 95%CI 0,53 – 0,83), giảm 26% tỷ lệ nhồi máu cơ tim không tử vong (RR = 0,74; 95%CI 0,60 – 0,89), giảm 30% tỷ lệ cần tái thông mạch (RR = 0,70 ; 95%CI 0,53 – 0,83) và giảm 25% tỷ lệ đột quỵ (RR = 0,75; CI 95% 0,56 – 0,94).
- Các tác dụng phụ gồm tăng men gan, đau cơ vân tương tự nhóm bệnh nhân trẻ. Một dữ liệu từ hơn 30.000 bệnh nhân cho thấy simvastatin hoặc pravastatin không gây ra tình trạng xấu đi của chức năng nhận thức ở người cao tuổi. Thậm chí, một báo cáo sơ bộ gần đây cho thấy rằng statin thực sự có thể có ảnh hưởng có lợi nhỏ đến chức năng nhận thức ở bệnh nhân mắc chứng mất trí nhớ Alzheimer.
- Khuyến cáo của hội tim mạch châu Âu năm 2019 về điều trị rối loạn lipid máu cho người cao tuổi:
- Điều trị bằng statin được khuyến nghị cho người già mắc ASCVD theo cách tương tự như đối với bệnh nhân trẻ tuổi (IA).
- Điều trị bằng statin được khuyến cáo để phòng ngừa tiên phát, theo mức độ rủi ro, ở người lớn tuổi < 75 tuổi (IA).
- Bắt đầu điều trị bằng statin để phòng ngừa tiên phát ở người già > 75 tuổi có thể được xem xét, nếu có nguy cơ cao hoặc rất cao(IIb-B).
- Khuyến cáo rằng statin được bắt đầu với liều thấp nếu có suy thận đáng kể và/hoặc có khả năng dùng thuốc tương tác và sau đó chuẩn độ lên để đạt được mục tiêu điều trị LDL-C (IC).
3.4. Thuốc điều trị rối loạn lipid ở bệnh nhân đái tháo đường
(xem mục 6, chương 15: Sử dụng thuốc ở bệnh nhân đái tháo đường có bệnh lý tim mạch).
3.5. Thuốc điều trị rối loạn lipid ở bệnh nhân bệnh thận mạn tính (CKD) và sau ghép tạng
- CKD giai đoạn từ 3- 5 được xếp vào nhóm nguy cơ tim mạch cao hoặc rất cao (IA)
- Nên sử dụng kết hợp statin hoặc statin/ezetimibe ở bệnh nhân CKD giai đoạn 3-5 không phụ thuộc lọc máu (IA).
- Ở những bệnh nhân đã sử dụng statin, ezetimibe hoặc kết hợp statin/ezetimibe tại thời điểm lọc máu bắt đầu, tiếp tục của các loại thuốc trên nên được xem xét, đặc biệt ở những bệnh nhân có bệnh tim mạch do xơ vữa. (IIa-C ).
- Ở những bệnh nhân bị CKD phụ thuộc lọc máu, người không có bệnh lý tim mạch do xơ vữa, bắt đầu liệu pháp không được khuyến cáo (IIIA).
- Rối loạn lipid máu rất hay gặp ở các bệnh nhân sau ghép tạng. Quản lý rối loạn lipid máu ở các bệnh nhân này tương tự như nhóm bệnh nhân nguy cơ cao hoặc rất cao.
- Statin là thuốc lựa chọn hàng đầu ở bệnh nhân ghép tạng có rối loạn lipid máu. Khởi đầu nên dùng từ liều thấp tăng dần. Nếu đích điều trị không đạt được sau khi dùng statin đến liều tối đa dung nạp được hoặc bệnh nhân không dung nạp statin có thể thay bằng ezetimibe. Cần chú ý tương tác giữa statin với các thuốc ức chế miễn dịch, đặc biệt là cyclosporin.
3.6. Thuốc điều trị rối loạn lipid và đột quỵ não
a. Vai trò của statin trong dự phòng tiên phát đột quỵ nhồi máu não
Rối loạn lipid máu là một trong những yếu tố nguy cơ chính của bệnh mạch vành. Tuy nhiên, mối liên quan giữa nồng độ cholesterol và tỷ lệ mắc đột quỵ não còn khá phức tạp, thay đổi theo từng loại đột quỵ. Trong một nghiên cứu, mối liên quan giữa nồng độ cholesterol và mảng xơ vữa hệ mạch cảnh gợi ý vai trò của cholesterol trong cơ chế bệnh sinh của nhồi máu não do tổn thương các mạch máu lớn.
Statin làm giảm nguy cơ đột quỵ, trong khi các phương pháp khác (ví dụ: fibrates, resin, chế độ ăn) không làm thay đổi tỷ lệ mắc đột quỵ một cách có ý nghĩa. Một phân tích tổng hợp gần đây từ các thử nghiệm ngẫu nhiên có đối chứng trên 94.283 bệnh nhân, cho thấy dùng statin ,với mục đích dự phòng tiên phát các biến cố tim mạch, không chỉ làm giảm có ý nghĩa tỷ lệ nhồi máu cơ tim, tử vong tim mạch, tử vong do mọi nguyên nhân mà còn làm giảm tỷ lệ đột quỵ nhồi máu não.
Trong một phân tích tổng hợp khác từ được tiến hành năm 2011, nhóm statin, mặc dù không làm giảm nguy cơ mắc đột quỵ nguy hiểm nhưng làm giảm một cách có ý nghĩa tỷ lệ mắc đột quỵ không nguy hiểm so với giả dược. Cần lưu ý rằng, các bệnh nhân được chọn vào các nghiên cứu kể trên đều có nguy cơ mắc biến cố tim mạch 10 năm thấp. Điều này chứng minh rằng nhóm statin có hiệu quả trong dự phòng tiên phát đột quỵ nhồi máu não.
b. Vai trò của statin trong dự phòng thứ phát đột quỵ nhồi máu não
Thử nghiệm SPARCL cho thấy liều 80 mg atorvastatin làm giảm một cách có ý nghĩa tỷ lệ tái đột quỵ trong vòng 5 năm. Một nghiên cứu khác trên gần 3.000 bệnh nhân có đột quỵ nhồi máu não mới hoặc nhồi máu não thoáng qua cho thấy tỷ lệ nhồi máu não tái phát và biến cố mạch vành thấp hơn có ý nghĩa ở nhóm đạt mục tiêu LDL-C < 70 mg/dL so với nhóm có mục tiêu 90 – 110 mg/dL (khi dùng bất kể loại statin nào hoặc phối hợp ezetimibe nếu cần thiết). Sử dụng statin sau đột quỵ nhồi máu não thực sự giúp làm giảm nguy cơ: đột quỵ não tái phát (giảm 12% với mỗi mmol/L LDL-C được hạ), nhồi máu cơ tim và tử vong tim mạch. Sử dụng statin sau đột quỵ nhồi máu não thoáng qua cũng làm giảm nguy cơ mắc đột quỵ sớm ở những bệnh nhân có hẹp động mạch cảnh.
Theo ESC 2019, bệnh nhân có tiền sử đột quỵ nhồi máu não hoặc nhồi máu não thoáng qua có nguy cơ biến cố tim mạch rất cao, đặc biệt là nguy cơ nhồi máu não tái phát, vì vậy khuyến cáo điều trị hạ LDL-C tích cực trên nhóm bệnh nhân này (I-A).
Tóm lại: Statin có vai trò quan trọng trong dự phòng tiên phát và thứ phát đột quỵ nhồi máu não. Việc lựa chọn loại statin nào phụ thuộc vào LDL-C mục tiêu theo mức nguy cơ tim mạch và bệnh cảnh lâm sàng của từng bệnh nhân.
c. Nguy cơ xuất huyết não ở bệnh nhân dùng statin
Một vài nghiên cứu chỉ ra mối liên quan giữa nồng độ cholesterol cao và tỷ lệ mắc đột quỵ nhồi máu não, đặc biệt là nhóm có tổn thương mạch máu lớn và nhóm nhồi máu ổ khuyết, nhưng mối liên quan với đột quỵ xuất huyết não lại ngược lại. Tuy nhiên, lo ngại về việc statin làm tăng nguy cơ xuất huyết não lại không được các bằng chứng ủng hộ.
Một phân tích tổng hợp 4 nghiên cứu đánh giá vai trò của statin trên 8832 bệnh nhân có tiền sử bệnh mạch máu não cho thấy, statin làm giảm nguy cơ đột quỵ tổng thể (RR = 0,88; 95%CI 0,78 – 0,99). Trong đó, statin làm giảm nguy cơ đột quỵ nhồi máu não (RR = 0,80, 95%CI: 0,70 – 0,92) và statin làm tăng nguy cơ đột quỵ xuất huyết (RR = 1,73, 95%CI 1,19 – 2,50).
Tuy nhiên, một phân tích tổng hợp 31 nghiên cứu ngẫu nhiên có đối chứng trên 182.803 bệnh nhân, trong đó 91.588 bệnh nhân dùng statin và 91.215 bệnh nhân nhóm chứng. Không có sự khác biệt đáng kể về tỷ lệ xuất huyết nội sọ được quan sát trong nhóm điều trị statin so với nhóm chứng (OR = 1,08; 95% CI, 0,88 – 1,32; P = 0,47). Nguy cơ xuất huyết nội sọ không liên quan đến mức độ giảm LDL-C hoặc có đạt được LDL-C mục tiêu hay không. Nguy cơ đột quỵ tổng thể giảm có ý nghĩa (OR = 0,84; 95% CI, 0,78 – 0,91; p < 0,0001) và tỷ lệ tử vong do mọi nguyên nhân đã giảm đáng kể (OR = 0,92; 95%CI 0,87 – 0,96; p = 0,0007) ở nhóm dùng statin.
Các nghiên cứu trên bệnh nhân xuất huyết nội sọ cũng cho thấy: Sử dụng statin trước xuất huyết nội sọ không làm tăng tỷ lệ tử vong và suy giảm các chức năng ở bệnh nhân này. Sử dụng statin sau xuất huyết nội sọ cũng không liên quan đến việc tăng nguy cơ tái phát tình trạng bệnh lý này.
Tóm lại: Việc sử dụng statin không làm tăng nguy cơ xuất huyết não và mức độ nặng của xuất huyết não. Việc sử dụng statin sau xuất huyết nội sọ cũng không liên quan đến việc tăng nguy cơ tái phát của bệnh lý này.
3.7. Thuốc điều trị rối loạn lipid máu ở bệnh nhân có bệnh động mạch ngoại biên (PAD)
Các nghiên cứu đều chứng minh việc giảm LDL-C tối ưu giúp cải thiện kết cục ở bệnh nhân bệnh động mạch ngoại biên, với giảm mạnh nguy cơ tuyệt đối. Kết quả này cùng với các dữ liệu về tính an toàn của liệu pháp giảm LDL-C ủng hộ quan điểm giảm LDL-C nhiều nhất có thể ở bệnh nhân bệnh động mạch ngoại biên với liệu pháp statin, ezetimibe và ức chế PCSK9.
Nhìn chung, vai trò của statin trên các biến cố tim mạch chính ở bệnh nhân có bệnh động mạch ngoại biên tương tự ở các bệnh nhân có bệnh lý tim mạch do xơ vữa khác. Statin giúp làm giảm tỷ lệ nhồi máu cơ tim, giảm tỷ lệ đột quỵ não và tỷ lệ tử vong chung do tim mạch.
Tuy nhiên còn rất ít nghiên cứu đánh giá hiệu quả của statin trên các biến cố chi (bao gồm đau cách hồi, thiếu máu chi cấp, cắt cụt chi, tái thông mạch máu chi. Nghiên cứu 4S báo cáo giảm triệu chứng đau cách hồi khi sử dụng simvastatin và trong nghiên cứu HPS, việc sử dụng simvastatin ở bệnh nhân bệnh động mạch ngoại biên làm giảm 16% các biến cố mạch máu ngoại biên so với giả dược, chủ yếu do giảm 20% nguy cơ tương đối phải tái thông mạch máu (không phải ĐMV). Các hiệu quả này độc lập với mức LDL-C ban đầu.
Nghiên cứu REACH trên 5.861 bệnh nhân mắc bệnh động mạch ngoại biên có triệu chứng, có 62,2% bệnh nhân sử dụng liệu pháp statin tại thời điểm bắt đầu. Sau khi điều chỉnh các sự khác biệt, liệu pháp statin làm giảm 18% triệu chứng đau cách hồi chi dưới trầm trọng hoặc thiếu máu chi trầm trọng mạn tính, cũng như giảm 17% tỷ lệ tái thông mạch máu ngoại biên. Đồng thời, liệu pháp statin làm giảm 56% tỷ lệ cắt cụt chi. Mặc dù, sự so sánh này không ngẫu nhiên nhưng các phân tích trên đã được điều chỉnh các yếu tố nhiễu tiềm tàng và được thống nhất qua một loạt các phân tích độ nhạy.
Vai trò của thuốc điều trị rối loạn lipid máu khác trên bệnh động mạch ngoại biên: Những lợi ích rộng hơn của việc giảm LDL-C đối với biến cố chi được thể hiện trong nhóm bệnh động mạch ngoại biên trong thử nghiệm FOURIER. Phức hợp các biến cố chi do thiếu máu cục bộ bao gồm thiếu máu chi cấp, cắt cụt chi rộng rãi và tái thông mạch máu cấp cứu. Evolocumab làm giảm 42% tỷ lệ xuất hiện các biến cố chi ở nhóm có bệnh lý mạch máu do xơ vữa. Ở các bệnh nhân mắc bệnh động mạch ngoại biên có triệu chứng, evolocumab làm giảm 57% nguy cơ xuất hiện các biến cố chi trong 2,5 năm. Hiệu quả của alirocumab đối các biến cố chi tương tự evolocumab được thể hiện qua nghiên cứu ODYSSEY Outcomes.
Không rõ liệu việc tăng HDL-C hoặc nhóm fibrates có tác động đến biến cố chi thể hay không. Một nghiên cứu duy nhất báo cáo việc sử dụng fenofibrate ở bệnh nhân mắc đái tháo đường và bệnh động mạch ngoại biên làm giảm 36% nguy cơ cắt cụt chi so với giả dược trên 5 năm, có thể thông qua cơ chế không qua trung gian LDL-C. Những quan sát này cần được khẳng định trong các nghiên cứu trong tương lai.
4. THEO DÕI BỆNH NHÂN TRONG QUÁ TRÌNH ĐIỀU TRỊ RỐI LOẠN LIPID MÁU
4.1. Mục tiêu
- Theo dõi mức tuân thủ điều trị của bệnh nhân cả về thuốc và các biện pháp thay đổi lối sống.
- Theo dõi hiệu quả điều trị và điều chỉnh liều các thuốc hạ lipid máu để đạt mục tiêu lipid máu cho bệnh nhân.
- Theo dõi về lâm sàng các tác dụng không mong muốn của các thuốc điều trị, làm xét nghiệm thăm dò và xử trí khi cần thiết, thường gặp nhất là bệnh cơ do statin/fibrate và tăng men AST/ALT (hay GOT/GPT).
4.2. Theo dõi bilan lipid máu
Trước khi đạt mục tiêu: Xét nghiệm bilan lipid máu thường được tiến hành mỗi 4 – 12 tháng sau khi khởi trị các thuốc hạ lipid máu hoặc sau mỗi lần thay đổi liều/phối hợp các thuốc hạ lipid máu.
Khi đạt mục tiêu: Xét nghiệm bilan lipid máu hằng năm, (trừ khi bệnh nhân bỏ điều trị hoặc có các bệnh lý đi kèm/nguy cơ khác cần phải theo dõi thường xuyên hơn).
4.3. Bệnh cơ do statin/fibrate
– Đây là tác dụng không mong muốn thường gặp. Thường gặp nhất là các triệu chứng đau mỏi/căng cứng cơ sau một thời gian sử dụng statin/fibrate (khoảng 10 – 15% bệnh nhân).
– Hoại tử cơ là một biến chứng nặng, có thể gây tử vong, tuy vậy khá hiếm gặp, tỷ lệ khoảng 1 – 3/100000 bệnh nhân điều trị statin/fibrate. Triệu chứng gồm đau cơ, hoại tử cơ, đái đỏ (đái myoglobin), xét nghiệm thường thấy CK tăng cao trên 10 lần (có thể tới 40 lần), suy thận cấp do hoại tử ống thận, các trường hợp nặng có thể kèm theo vô niệu dẫn đến toan chuyển hóa, rối loạn điện giải…
– Điều trị bệnh nhân có hoại tử cơ vân cấp:
- Tạm dừng statin/fibrate cho đến khi nồng độ CK trở về bình thường. Về vấn đề tái sử dụng statin/fibrate xin xem thêm ở phần sau.
- Monitor theo dõi, đặt catheter tĩnh mạch trung tâm nếu có thể.
- Truyền dịch đảm bảo duy trì CVP 8 – 12 cmH2O hoặc theo dõi tĩnh mạch chủ dưới nếu có điều kiện.
- Cần dùng lợi tiểu cưỡng bức (thường là furosemide) để duy trì lượng nước tiểu trong trường hợp bệnh nhân đã đủ dịch mà lượng nước tiểu < 100 mL/h.
- Điều chỉnh các rối loạn điện giải, toan kiềm nếu có.
- Cân nhắc điều trị thay thế thận tạm thời trong giai đoạn cấp.
4.4. Tăng men AST/ALT
– Tăng nhẹ nồng độ AST gặp ở khoảng 0,5 – 2% các bệnh nhân sử dụng statin, thường gặp ở các bệnh nhân sử dụng statin mạnh (rosuvastatin, atorvastatin) hoặc liều cao.
– Tăng nồng độ AST máu không phản ánh tổn thương hủy hoại tế bào gan thực sự và hầu như không bao giờ tiến triển gây ảnh hưởng đến chức năng gan/suy gan. Vì vậy hiện nay không có khuyến cáo theo dõi định kỳ ALT ở các bệnh nhân sử dụng statin kéo dài không có triệu chứng.
– Xét nghiệm nồng độ AST máu nên được tiến hành 1 lần duy nhất sau 8 – 12 tuần kể từ khi bắt đầu khởi trị/sau khi nâng liều statin.
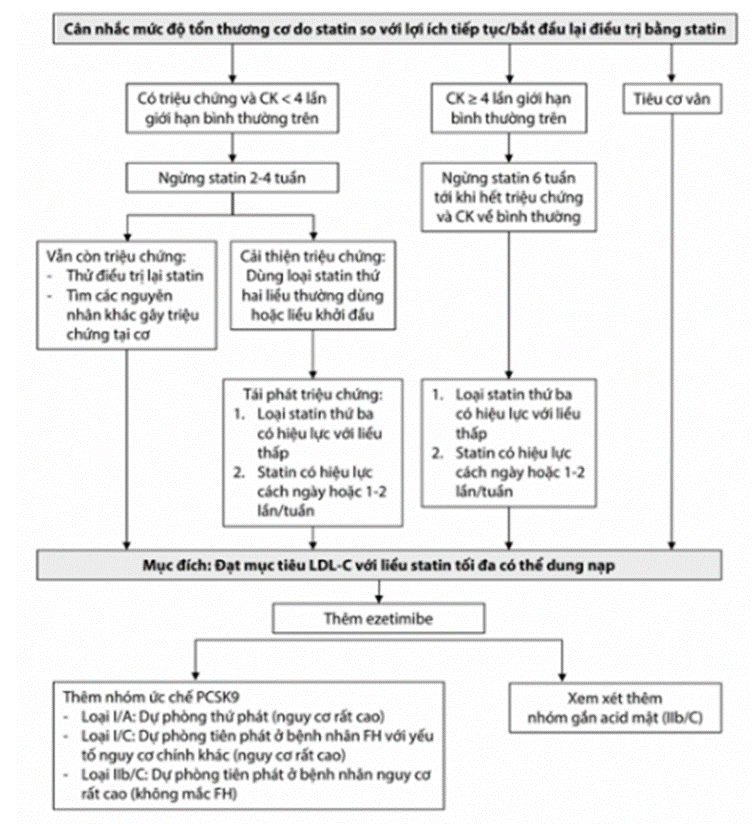
Hình 16.2: Xử trí tăng ALT ở bệnh nhân đang dùng statin (theo ESC 2019)
TÀI LIỆU THAM KHẢO
- Phạm Mạnh Hùng và cộng sự. Lâm sàng tim mạch học, nhà xuất bản y học, 2019.
- Ford I, Murray H, McCowan C, Packard CJ. Long-Term Safety and Efficacy of Lowering Low-Density Lipoprotein Cholesterol With Statin Therapy: 20-Year Follow-Up of West of Scotland Coronary Prevention Study. Circulation 2016; 133:1073.
- Vallejo-Vaz AJ, Robertson M, Catapano AL, et al. Low-Density Lipoprotein Cholesterol Lowering for the Primary Prevention of Cardiovascular Disease Among Men With Primary Elevations of Low-Density Lipoprotein Cholesterol Levels of 190 mg/dL or Above: Analyses From the WOSCOPS (West of Scotland Coronary Prevention Study) 5-Year Randomized Trial and 20-Year Observational Follow-Up. Circulation 2017; 136:1878.
- Downs JR, Clearfield M, Weis S, et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA 1998; 279:1615.
- Yusuf S, Bosch J, Dagenais G, et al. Cholesterol Lowering in Intermediate-Risk Persons without Cardiovascular Disease. N Engl J Med 2016; 374:2021.
- Cholesterol Treatment Trialists’ (CTT) Collaborators, Mihaylova B, Emberson J, et al. The effects of lowering LDL cholesterol with statin therapy in people at low risk of vascular disease: meta-analysis of individual data from 27 randomised trials. Lancet 2012; 380:581.
- Ray KK, Seshasai SR, Erqou S, et al. Statins and all-cause mortality in high-risk primary prevention: a meta-analysis of 11 randomized controlled trials involving 65,229 participants. Arch Intern Med 2010; 170:1024.
- Silverman MG, Ference BA, Im K, et al. Association Between Lowering LDL-C and Cardiovascular Risk Reduction Among Different Therapeutic Interventions: A Systematic Review and Meta-analysis. JAMA 2016; 316:1289.
- Cholesterol Treatment Trialists’ (CTT) Collaboration, Baigent C, Blackwell L, et al. Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170,000 participants in 26 randomised trials. Lancet 2010; 376:1670.
- LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med 2005; 352:1425.
- Cannon CP, Blazing MA, Giugliano RP, et al. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015; 372:2387.
- Navarese EP, Kolodziejczak M, Schulze V, et al. Effects of Proprotein Convertase Subtilisin/Kexin Type 9 Antibodies in Adults With Hypercholesterolemia: A Systematic Review and Meta-analysis. Ann Intern Med 2015; 163:40.
- Sabatine MS, Giugliano RP, Keech AC, et al. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med 2017; 376:1713.
- Sabatine MS, Wiviott SD, Im K, et al. Efficacy and Safety of Further Lowering of Low-Density Lipoprotein Cholesterol in Patients Starting With Very Low Levels: A Meta-analysis. JAMA Cardiol 2018; 3:823.
- Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA 2005; 294:2437.
- Jacobson TA, Ito MK, Maki KC, et al. National lipid association recommendations for patient-centered management of dyslipidemia: part 1–full report. J Clin Lipidol 2015; 9:129.
- O’Keefe JH, DiNicolantonio JJ, Lavie CJ. Statins, Ezetimibe, and Proprotein Convertase Subtilisin-Kexin Type 9 Inhibitors to Reduce Low-Density Lipoprotein Cholesterol and Cardiovascular Events. Am J Cardiol 2017; 119:565